NHẬN XÉT CHUNG
Khi nhận biết các ion trong dung dịch, cần nhớ rằng sự có mặt của một số ion trong dung dịch còn phụ thuộc vào sự có mặt các ion khác có khả năng phản ứng với chúng.
1. Nhận biết anion NO−3
Nếu trong dung dịch không có anion có khả năng oxi hóa mạnh thì có thể dùng bột Cu hoặc vài mẫu lá Cu mỏng và môi trường axit của axit sunfuric loãng để nhận biết anion NO−3:
3Cu+2NO−3+8H+→3Cu2++2NO↑+4H2O
Bột Cu tan ra tạo thành dung dịch màu xanh, khí NO không màu bay lên gặp khí oxi của không khí, tạo thành khí NO2 có màu nâu đỏ.
2NO+O2→2NO2
màu nâu đỏ
2. Nhận biết anion SO2−4
Thuốc thử đặc trưng cho anion này là dung dịch BaCl2 trong môi trường axit loãng dư (HCl hoặc HNO3 loãng):
Ba2++SO2−4→BaSO4↓
Môi trường axit dư là cần thiết, vì một loạt anion như: CO2−3,PO3−4,SO2−3,HPO2−4 cũng cho kết tủa trắng với ion Ba2+, nhưng các kết tủa đó đều tan trong các dung dịch HCl hoặc HNO3 loãng, riêng BaSO4 không tan.
3. Nhận biết anion Cl−
Thuốc thử đặc trưng của anion này là dung dịch bạc nitrat AgNO3 trong môi trường HNO3 loãng:
Ag++Cl−→AgCl↓
Các anion Br−,I− cũng cho phản ứng tương tự, tạo thành các kết tủa AgBr và AgI tương ứng có độ tan nhỏ hơn AgCl nhiều. Tuy nhiên, khác với AgBr và AgI,AgCl tan được trong dung dịch NH3 loãng:
AgCl↓+2NH3→[Ag(NH3)2]++Cl−
nên có thể dùng dung dịch NH3 loãng để tách AgCl ra khỏi hỗn hợp với AgBr và AgI.
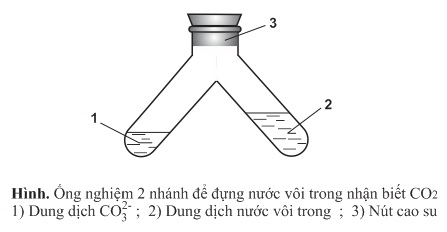
4. Nhận biết anion CO2−3
Axit H2CO3 là axit yếu, dễ bay hơi, dễ dàng phân hủy ngay tại nhiệt độ phòng:
H2CO3→CO2+H2O
Vì vậy, anion CO2−3 chỉ tồn tại trong các dung dịch bazơ, CO2 rất ít tan trong nước, nên khi axit hóa dung dịch CO2−3 bằng các dung dịch axit mạnh (HCl,H2SO4 loãng) thì CO2 sẽ giải phóng ra khỏi dung dịch, gây sủi bọt khá mạnh. Nếu dùng dụng cụ đặc biệt đựng lượng dư nước vôi trong, ta sẽ quan sát được sựu tạo thành kết tủa trắng CaCO3 làm vẫn đục nước vôi trong đó:
CO2−3+2H+→CO2↑+H2O
CO2+Ca(OH)2→CaCO3↓+H2O

.jpg)
.jpg)




.jpg)
.jpg)










