I - LƯU HUỲNH ĐIOXIT
1. Cấu tạo phân tử
Nguyên tử lưu huỳnh ở trạng thái kích thích có 4 electron độc thân ở các phân lớp 3p và 3d:...3s23p33d1. Những electron độc thân này của nguyên tử S liên kết với 4 electron độc thân của hai nguyên tử O tạo thành bốn liên kết cộng hóa trị có cực:

. Tính chất vật lí
Lưu huỳnh đioxit hay khí sunfurơ là chất khí không màu, mùi hắc, nặng hơn hai lần không khí (d=64/29≈2,2), hóa lỏng ở −10oC.
Lưu huỳnh đioxit tan nhiều trong nước (1 thể tích nước ở 20oC hòa tan được 40 thể tích khí SO2).
Lưu huỳnh đioxit là khí độc, hít thở phải không khí có SO2 sẽ gây viêm đường hô hấp.
3. Tính chất hóa học
a) Lưu huỳnh đioxit là oxit axit
SO2 tan trong nước tạo thành dung dịch axit sunfurơ (H2SO3):
SO2+H2O⇌H2SO3
H2SO3 là axit yếu (mạnh hơn axit sunfuhiđric) và không bền (ngay trong dung dịch, H2SO3 cũng bị phân hủy thành SO2 và H2O ).
SO2 tác dụng với dung dịch bazơ, tạo nên 2 muối: muối trung hòa, như Na2SO3, chứa ion sunfit SO2−3 và muối axit, như NaHSO3, chứa ion hiđrosunfit (HSO−3).
b) Lưu huỳnh đioxit là chất khử và là chất oxi hóa
Trong hợp chất SO2, nguyên tố lưu huỳnh có số oxi hóa +4, là số oxi hóa trung gian giữa các số oxi hóa −2 và +6. Do vậy, khi tham gia phản ứng oxi hóa - khử, SO2 có thể bị khử hoặc bị oxi hóa.
Thí dụ:
Lưu huỳnh đioxit là chất khử khi tác dụng với những chất oxi hóa mạnh, như halogen, kali pemanganat,...
Lưu huỳnh đioxit là chất oxi hóa khi tác dụng với chất khử mạnh hơn, như H2S,Mg,...
4. Lưu huỳnh đioxit - Chất gây ô nhiễm
Lưu huỳnh đioxit là một trong các chất chủ yếu gây ô nhiễm môi trường. Nó được sinh ra do sự đốt cháy các nhiên liệu hóa thạch (than, dầu, khí đốt), thoát vào bầu khí quyển và là một trong những nguyên nhân chính gây ra mưa axit. Mưa axit tàn phá nhiều rừng cây, công trình kiến trúc bằng đá và kim loại, biến đất đai trồng trọt thành những vùng hoang mạc. Không khí có SO2 gây hại cho sức khỏe con người (gây viêm phổi, mắt, da).
5. Ứng dụng và điều chế lưu huỳnh đioxit
a) Ứng dụng
Lưu huỳnh đioxit được dùng để:
- Sản xuất axit sunfuric.
- Tẩy trắng giấy, bột giấy.
- Chống nấm mốc cho lương thực, thực phẩm,...
b) Điều chế
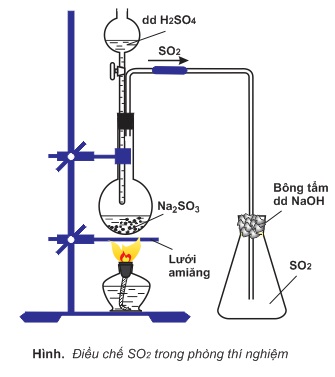
- Trong phòng thí nghiệm, SO2 được điều chế bằng cách đun nóng dung dịch axit H2SO4 với muối Na2SO3.
Na2SO3+H2SO4→Na2SO4+H2O+SO2↑
Thu SO2 vào bình bằng cách đẩy không khí.
- Trong công nghiệp, SO2 được điều chế bằng cách:
+ Đốt cháy lưu huỳnh.
+ Đốt quặng sunfua kim loại, như pirit sắt (FeS2):
4FeS2+11O2→2Fe2O3+8SO2↑
II - LƯU HUỲNH TRIOXIT
1. Cấu tạo phân tử
Nguyên tử lưu huỳnh ở trạng thái kích thích có thể có cấu hình electron lớp ngoài cùng là: 3s13p33d2
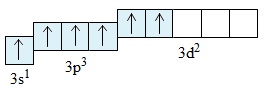
Ở trạng thái này, nguyên tử S có 6 electron độc thân, do vậy nguyên tử S có thể liên kết với 6 electron độc thân của ba nguyên tử O tạo ra sáu liên kết cộng hóa trị. Mỗi nguyên tử O liên kết với nguyên tử S bằng một liên kết đôi:

Trong hợp chất SO3, nguyên tố S có số oxi hóa cực đại là +6.
2. Tính chất, ứng dụng và điều chế
a) Tính chất vật lí
Ở điều kiện thường, SO3 là chất lỏng không màu (nóng chảy ở 17oC, sôi ở 45oC). SO3 tan vô hạn trong nước và trong axit sunfuric.
b) Tính chất hóa học
Lưu huỳnh trioxit là oxit axit, tác dụng rất mạnh với nước tạo thành axit sunfuric và tỏa nhiều nhiệt:
SO3+H2O→H2SO4
Ngoài ra, SO3 tác dụng được với oxĩt bazơ, bazơ tạo thành muối sunfat.
c) Ứng dụng và điều chế
SO3 ít có ứng dụng thực tiễn, tuy nhiên nó là sản phẩm trung gian để sản xuất axit có tầm quan trong bậc nhất trong công nghiệp là axit sunfuric.
Trong công nghiệp, SO3 được điều chế bằng cách oxi hóa SO2 ở nhiệt độ cao (450oC−500oC) có chất xúc tác là V2O5.
2SO2+O2⇌2SO3
III - AXIT SUNFURIC
1. Cấu tạo phân tử

Trong hợp chất H2SO4, nguyên tố S có số oxi hóa cực đại là +6.
2. Tính chất vật lí
Axit sunfuric là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp hai lần nước (H2SO4 98%cóD=1,84g/cm3). H2SO4 đặc rất dễ hút ẩm, tính chất này được dùng làm khô khí ẩm.
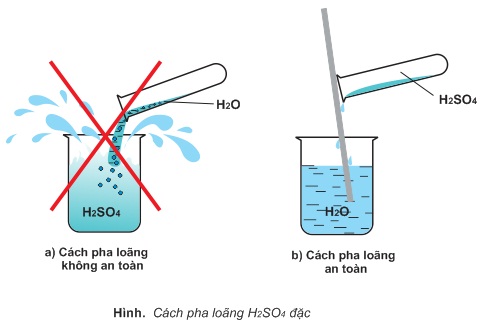
Axit sunfuric đặc tan trong nước, tạo thành những hiđrat H2SO4.nH2O và tỏa một lượng nhiệt lớn. Nếu rót nước vào axit H2SO4 đặc, nước sôi đột ngột kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Vì vậy muốn pha loãng axit sunfuric đặc, người ta rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh, tuyệt đối không làm ngược lại.
3. Tính chất hóa học
a) Tính chất của dung dịch axit sunfuric loãng
Dung dịch axit sunfuric loãng có những tính chất chung của axit:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại hoạt động, giải phóng khí hiđro.
- Tác dụng với muối của những axit yếu.
- Tác dụng với oxit bazơ và bazơ.
b) Tính chất của axit sunfuric đặc
Axit sunfuric đặc có một số tính chất hóa học đặc trưng sau:
Tính oxi hóa mạnh:
- Axit sunfuric đặc và nóng có tính oxi hóa rất mạnh, nó oxi hóa được hầu hết các kim loại (trừ Au,Pt), nhiều phi kim như C,S,P,... và nhiều hợp chất
- Axit sunfuric đặc, nguội làm một số kim loại như Fe,Al,Cr,... bị thụ động hóa.
Tính háo nước:
Axit sunfuric đặc chiếm nước kết tinh của nhiều muối hiđrat (muối ngậm nước) hoặc chiếm các nguyên tố H và O (thành phần của nước) trong nhiều hợp chất:
- Muối CuSO4.5H2O màu xanh tác dụng với H2SO4 đặc sẽ biến thành CuSO4 khan màu trắng
Hợp chất gluxit (cacbonhiđrat) tác dụng với H2SO4 đặc bị biến thành cacbon (than):
Một phần sản phẩm C bị H2SO4 đặc oxi hóa thành khí CO2, cùng với khí SO2 gây hiện tượng sủi bọt đẩy cacbon trào ra ngoài cốc:
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng.
4. Ứng dụng
Hàng năm, thế giới sản xuất khoảng 160 triệu tấn H2SO4. Axit sunfuric là hóa chất hàng đầu trong nhiều ngành sản xuất.
5. Sản xuất axit sunfuric
Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc. Phương pháp này gồm ba công đoạn chính:
a) Sản xuất SO2
Tùy thuộc vào nguồn nguyên liệu có sẵn mà phương pháp sản xuất SO2 có khác nhau.
- Thiêu quặng pirit sắt (FeS2):
4FeS2+11O2→2Fe2O3+8SO2
- Đốt cháy lưu huỳnh:
S+O2→SO2
b) Sản xuất SO3
Oxi hóa SO3 bằng khí oxi hoặc lượng dư không khí ở nhiệt độ 450−500oC, chất xúc tác là V2O5:
xúc tác, to
2SO2+O2⇌2SO3
c) Sản xuất H2SO4
Khí SO3 đi từ dưới lên đỉnh tháp, H2SO4 đặc chảy từ đỉnh tháp xuống dưới.
Dùng H2SO4 98% hấp thụ SO3 được oleum H2SO4.nSO3.
H2SO4+nSO3→H2SO4.nSO3
Sau đó dùng lượng nước thích hợp pha loãng oleum, được H2SO4 đặc:
H2SO4.nSO3+nH2O→(n+1)H2SO4
6. Muối sunfat và nhận biết ion sunfat
a) Muối sunfat
Muối sunfat là muối của axit sunfuric. Có 2 loại muối sunfat:
- Muối trung hòa (muối sunfat) chứa ion sunfat (SO2−4). Phần lớn muối sunfat đều tan, trử BaSO4,CaSO4,PbSO4,...không tan.
- Muối axit (muối hiđrosunfat) chứa ion hiđrosunfat (HSO−4).
b) Nhận biết ion sunfat
Dùng dung dịch muối bari để nhận biết ion SO2−4 trong dung dịch H2SO4 hoặc trong dung dịch muối sunfat. Phản ứng sinh ra kết tủa trắng không tan trong axit hoặc kiềm.
H2SO4(dd)+BaCl2(dd)→BaSO4(r)+2HCl(dd)
Na2SO4(dd)+BaCl2(dd)→BaSO4(r)+2NaCl(dd)

.jpg)
.jpg)




.jpg)
.jpg)










