1. Tính chất vật lí
Dung dịch Axit clohidric là một chất lỏng không màu, mùi xốc, "bốc khói" trong không khí ẩm. Ở 20oC, dung dịch HCl đặc nhất có nồng độ 37% và có khối lượng riêng là 1,19g/ml. Khi đun nóng trong dung dịch axit clohidric đặc, đầu tiên hidro clorua bay ra cùng với một lượng nhỏ hơi nước. Đến khi nồng độ dung dịch còn 20,2% thì HCl và H2O tạo thành một hỗn hợp đẳng phí, sôi ở 110oC.

Dung dịch axit clohidric
2. Tính chất hóa học
a. Tính axit
Dung dịch axit clohidric là một dung dịch axit mạnh. Những tính chất chung của một axit (làm đỏ quỳ tím, tác dụng với oxit base, base, tác dụng với muối, tác dụng với kim loại) đều thể hiện rõ nét ở dung dịch axit HCl:
Mg(OH)2 + 2HCl MgCl2 + 2H2O
CuO + 2HCl CuCl2 + H2O
CaCO3 + 2HCl CaCl2 + CO2 + H2O
Fe + 2HCl FeCl2 + H2
b. Tính khử
Trong phân tử HCl, clo có số oxi hóa -1. Đây là trạng thái oxi hóa thấp nhất của clo. Do đó, HCl còn thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh. Thí dụ:
K2Cr2O7 + 14HCl CrCl3 + 2KCl + 3Cl2 + 7H2O
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
3. Sản xuất
a. Trong phòng thí nghiệm
Người ta điều chế khí HCl từ NaCl rắn và axit sunfuric đậm đặc
NaCl + H2SO4 NaHSO4 + HCl
2NaCl + H2SO4 Na2SO4+ 2HCl
Phản ứng thứ nhất xảy ra ở nhiệt độ thường hoặc đun nóng không quá 250oC, phản ứng thứ hai xảy ra ở nhiệt độ cao hơn 400oC.
Hòa tan khí HCl vào nước cất, ta được dung dịch axit clohidric.
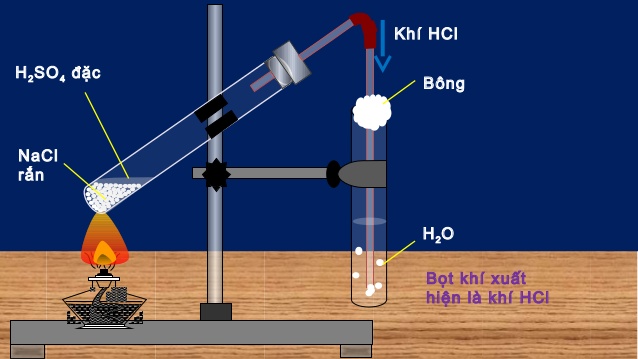
Điều chế HCl trong phòng thí nghiệm
b. Trong công nghiệp
- Trong công nghiệp, người ta cũng sản xuất axit clohidric từ NaCl và H2SO4 đặc. Phương pháp này gọi là phương pháp sunfat.
- Để thu được HCl tinh khiết, người ta sản xuất HCl bằng phương pháp tổng hợp từ hidro và clo (thu được khi điện phân dung dịch NaCl có màng ngăn)
H2 + Cl2 2HCl
Cần đốt để khơi mào cho phản ứng xảy ra trogn buồng đốt T1 (làm bằng than chì hay thạch anh), sau đó phản ứng tự xảy ra (phản ứng tỏa nhiệt). Khí HCl được nước hấp thụ ở hai tháp hấp thụ T2 và T3 theo nguyên tắc ngược dòng tạo ra dung dịch axit clohidric đặc.
- Ngày nay, một lượng lớn HCl thu được trong công nghiệp từ quá trình clo hóa các chất hữu cơ.
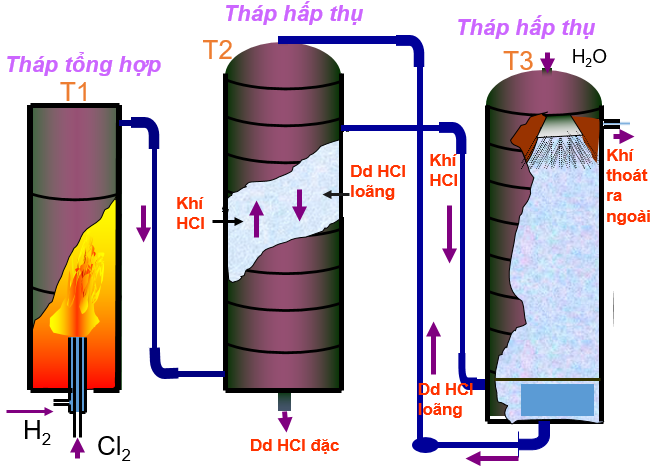
Điều chế axit clohidric trong công nghiệp
4. Ứng dụng
- Axit HCl để tẩy gỉ thép để loại bỏ gỉ trên thép bằng nồng độ Axit HCl 18% là phổ biến.
Fe2O3 + Fe + 6 HCl → 3 FeCl2 + 3 H2O
- Sản xuất các hợp chất hữu cơ như vinyl clorua và dicloroetan để sản xuất PVC hoặc than hoạt tính.
2 CH2=CH2 + 4 HCl + O2 → 2 ClCH2CH2Cl + 2 H2O
gỗ + HCl + nhiệt → than hoạt tính
- Sản xuất các hợp chất vô cơ theo phản ứng axit-bazơ để ra sản phẩm là hợp chất vô cơ. Để sử dụng làm chất keo tụ và chất đông tụ để làm lắng các thành phần trong quá trình xử lý nước thải, sản xuất nước uống, và sản xuất giấy hoặc việc mạ điện và kẽm clorua cho công nghiệp mạ và sản xuất pin.
- Kiểm soát và trung hòa pH cụ thể là điều chỉnh tính bazơ trong dung dịch.
OH− + HCl → H2O + Cl−
- Tái sinh bằng cách trao đổi ion. Axit HCl này được dùng để rửa các cation từ các loại nhựa đem lại loại nước đã được khử khoáng. công dụng này được ứng dụng trong tất cả các ngành công nghiệp hóa, sản xuất nước uống, và một số ngành công nghiệp thực phẩm.
- Trong sinh vật: Axit clohiđric chứa trong Axit gastric được tiết ra từ dạ dày se tạo môi trường axit trong dạ dày với pH từ 1 đến 2.
Một số phản ứng hóa học liên quan đến axit HCl được ứng dụng trong sản xuất thực phẩm, các thành phần thực phẩm và phụ gia thực phẩm. Các sản phẩm đặc trưng như aspartame, fructose, axít citric, lysine, thủy phân protein thực vật, và trong sản xuất gelatin.
Ngoài ra Axit HCl còn có ứng dụng khác như xử lý da, vệ sinh nhà cửa, và xây dựng nhà. Trong khai thác dầu, Axit HCl có thể được dùng để bơm vào trong tầng đá của giếng dầu nhằm hòa tan một phần đá hay còn gọi là “rửa giếng”, và tạo các lỗ rỗng lớn hơn.

.jpg)
.jpg)




.jpg)
.jpg)










