1. Khái niệm
Phản ứng este hóa là phản ứng giữa axit cacboxylic và ancol trong điều kiện nhiệt độ, có H2SO4 đặc làm xúc tác.
Phương trình phản ứng tổng quát: RCOOH + R'OH RCOOR' + H2O
Cơ chế phản ứng:
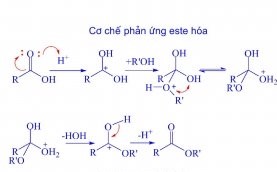
Cơ chế phản ứng este hóa theo Fiso là proton hóa và loại proton cùng với giai đoạn cộng và tách. Đầu tiên nhóm cacbonyl của axit cacboxylic bị proton hóa bởi xúc tác axit. Sau đó, ancol tấn công nucleophin yếu vào cacbon - cacbonyl.
Từ nồng độ chất phản ứng và sơ đồ có thể dùng để xác định hằng số cân bằng K, ta có
K = [RCOOR'].[H2O]/[RCOOH].[R'OH]
Hằng số cân bằng của phản ứng este hóa theo Fiso là nhỏ hơn 4.
Thí dụ, nếu K =4 và tỉ lệ về số mol của ancol và axit cacboxylic là 1:1 thì sản phẩm este thu được cao nhất là 67%.
Nồng độ các chất tại thời điểm cân bằng khi tỉ lệ về số mol của các chất phản ứng là 1:1 và K =4 là:
[RCOOR'] = 0,67 mol/l; [H2O] = 0,67 mol/l; [RCOOH] = 0,33 mol/l; [R'OH] = 0,33 mol/l
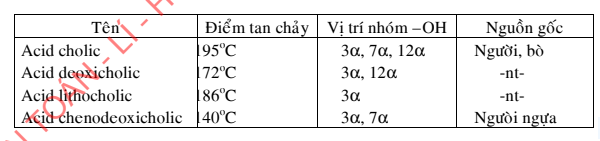
2. Đặc điểm của phản ứng este hóa
Phản ứng este hóa có 2 đặc điểm:
- Đặc điểm thứ nhất là phản ứng cần có xúc tác, nhiệt độ và xảy ra chậm theo cả hai hướng
Thí dụ: CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O
Khi không có xúc tác, với tỉ lệ tương đương của các chất phản ứng, nếu ở nhiệt độ phòng thì phải mất 16 năm mới đạt trạng thái cân bằng; Nếu ở 100oC phải cần 32 giời mới đạt hiệu suất 50%; nếu ở 150oC phải cần 24 giờ mới đạt hiệu suất 50%.
Phản ứng được xúc tiến nhanh nhờ chất xúc tác là ion H+ của axit H2SO4 hay HCl khan. Với phản ứng trên, dùng xúc tác là H2SO4 đặc, ở 140oC thì cần 6 giờ cho hiệu suất 67% so với lý thuyết. Lượng xúc tác H2SO4 cần từ 5-10% so với lượng ancol.
- Đặc điểm thứ hai là phản ứng thuận nghịch.
Chiều thuận là phản ứng este hóa, cần xúc tác là ion H+. Chiều nghịch là phản ứng thủy phân, cần xúc tác là axit hoặc bazo. Nếu dùng xúc tác là bazo kiềm như NaOH, KOH thì gọi là phản ứng xà phòng hóa và phản ứng xảy ra một chiều.
Phản ứng este hóa cho một hỗn hợp cân bằng giữa các chất phản ưng và các sản phẩm phản ứng.
Muốn chuyển dịch cân bằng, người ta có nhiều cách. Thí dụ, muốn chuyển dịch cân bằng theo chiều thuận, cần phải:
- Tăng nồng độ các chất phản ứng (ancol hoặc axit, thường thì tăng nồng độ ancol).
- Tách lấy một sản phẩm ra khỏi hỗn hợp phản ứng bằng cách chưng cất song song với việc tiến hành phản ứng.
Đối với chiều nghịch: Muốn cho phản ứng xảy ra hoàn toàn, cần dùng dung dịch NaOH hoặc KOH sẽ cho phản ứng xảy ra một chiều. Có thể so sánh phản ứng este hóa và phản ứng trung hòa. Hai phản ứng này đều giống nhau là sản phẩm có tạo ra nước, nhưng sự tách nước lại khác nhau.
Người ta đã dùng nguyên tử đánh dấu (đồng vị O18) để khảo sát phản ứng este hóa và chứng minh được rằng oxi nặng nằm trong cấu tạo của este, còn H2O thì không có.
Trong phản ứng este hóa, khả năng phản ứng của ancol và axit cacboxylic cũng thay đổi theo thứ tự sau:
HCOOH> CH3COOH> CH3CH2COOH> (CH3)2CHCOOH
CH3OH> CH3CH2OH> (CH3)2CHOH> (CH3)3COH

.jpg)
.jpg)




.jpg)
.jpg)










