I - PHÂN TÍNH ĐỊNH TÍNH
Phân tích định tính nguyên tố nhằm xác định các nguyên tố có mặt trong hợp chất hữu cơ bằng cách phân hủy hợp chất hữu cơ thành các hợp chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng.
1. Xác định cacbon và hiđro
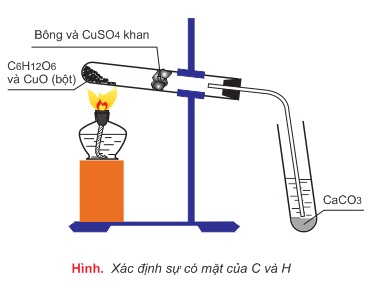
2. Xác định nitơ
Khi đun với axit sunfuric đặc, nitơ có trong một số hợp chất hữu cơ có thể chuyển thành muối amoni và được nhận biết dưới dạng amoniac:
CxHyOzNt →(H2SO4,to) (NH4)2SO4+...
(NH4)2SO4+2NaOH→to Na2SO4+2H2O+2NH3↑
3. Xác định halogen
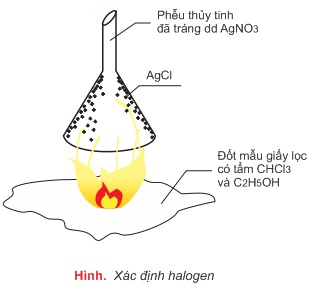
Khi đốt, hợp chất hữu cơ chứa clo bị phân hủy, clo tách ra dưới dạng HCl và được nhận biết bằng bạc nitrat:
CxHyOzClt→CO2+H2O+HCl
HCl+AgNO3→AgCl↓+HNO3
II - PHÂN TÍCH ĐỊNH LƯỢNG
Phân tích định lượng nhằm xác định tỉ lệ khối lượng (hàm lượng) các nguyên tố trong hợp chất hữu cơ. Người ta phân hủy hợp chất hữu cơ thành các hợp chất vô cơ đơn giản rồi định lượng chúng bằng phương pháp khối lượng, phương pháp thể tích hoặc phương pháp khác. Kết quả được biểu diễn ra tỉ lệ % về khối lượng.
1. Định lượng cacbon, hiđro
Oxi hóa hoàn toàn một lượng xác định hợp chất hữu cơ A(mA) rồi cho hấp thụ định lượng H2O và CO2 sinh ra. Hàm lượng hiđro (%H) tính từ khối lượng nước sinh ra (mH2O), hàm lượng %C tính từ khối lượng CO2(mCO2) sinh ra như sau:
%H=mH2O.2.100% / 18.mA ; %C=mCO2.12.100% / 44.mA
2. Định lượng nitơ
Nung m(mg) hợp chất A chứa N với CuO trong dòng khí CO2:
CxHyOzNt→ (to,CO2 CuO) CO2+H2O+N2
Hấp thụ CO2 và H2O bằng dung dịch KOH 40%, đo được thể tích khí còn lại.
Giả sử xác định được V(ml) khí nitơ (đktc) thì khối lượng nitơ (mN) và hàm lượng phần trăm của nitơ (%N) được tính như sau:
mN=28.V / 22,4(mg ); %N=mN.100% / mA
3. Định lượng các nguyên tố khác
Halogen: Phân hủy hợp chất hữu cơ, chuyển halogen thành HX rồi định lượng dưới dạng AgX(X=Cl,Br)
Lưu huỳnh: Phân hủy hợp chất hữu cơ rồi định lượng lưu huỳnh dưới dạng sunfat.
Oxi: Sau khi xác định C,H,N,halogen,S,... còn lại oxi.
4. Thí dụ
Nung 4,65mg một hợp chất hữu cơ A trong dòng khí oxi thì thu được 13,20mgCO2 và 3,16mgH2O. Ở thí nghiệm khác, nung 5,58mg hợp chất A với CuO thì thu được 0,67ml khí nitơ (đktc). Hãy tính hàm lượng phần trăm của C,H,N và O ở hợp chất A.
Theo các biểu thức cho ở mục 1 và 2 ta có:
%C=13,20.12.100% / 44.4,65=77,42% ; %N=0,67.28.100% / 22,4.5,58=15,01%
%H=3,16.2.100% / 18.4,65=7,55%;
%O=100%−(77,42%+7,55%+15,01%)=0,02%
Hợp chất A không chứa oxi (0,02%) là không đáng kể.

.jpg)
.jpg)




.jpg)
.jpg)










