I- KHÁI NIỆM
1. Thí dụ
Khi cho dòng điện một chiều đi qua muối NaCl nóng chảy, ở điện cực dương (nối với cực dương của nguồn điện) có khí clo thoát ra, còn ở cực âm (nối với cực âm của nguồn) người ta thu được kim loại natri. Quá trình này được gọi là sự điện phân muối NaCl nóng chảy, trong đó xảy ra các phản ứng sau đây:
- NaCl nóng chảy phân li thành ion: NaCl→Na++Cl−
Dưới tác dụng của điện trường, ion âm chuyển về điện cực dương, ion dương chuyển về cực âm.
- Ở cực dương (anot) xảy ra sự oxi hóa ion Cl−:2Cl−(l)→Cl2(k)+2e
Khi nghiên cứu pin điện hóa, chúng ta đã biết rằng trên anot xảy ra sự oxi hóa. Vì thế mà cực dương của thiết bị điện phân được gọi anot.
- Ở cực âm (catot) xảy ra sự khử ion Na+:2Na+(l)+2e→2Na(l)
Sự điện phân NaCl nóng chảy có thể biểu diễn ngắn gọn bằng sơ đồ:
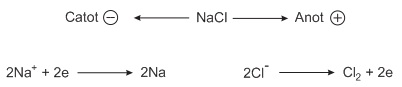
Phương trình của điện phân là: 2NaCl→đpnc 2Na+Cl2↑
2. Khái niệm
Sự điện phân là quá trình oxi hóa - khử xảy ra ở bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li
Như vậy, sự điện li là quá trình sử dụng điện năng để tạo ra sự biến đổi hóa học
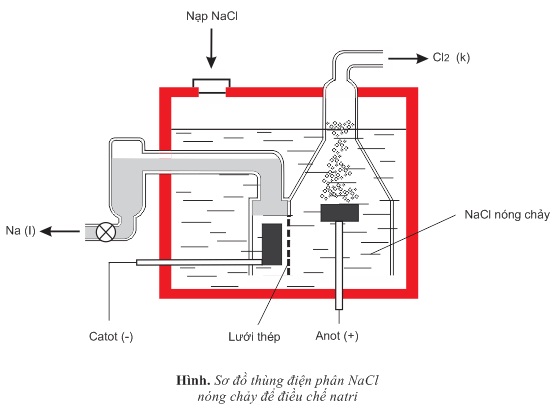
II- SỰ ĐIỆN PHÂN CÁC CHẤT ĐIỆN LI
1. Điện phân chất điện li nóng chảy
Ngoài quá trình điện phân NaCl nóng chảy đã nêu trên để điều chế Na và Cl2 còn có quá trình điện phân các chất nóng chảy như MgCl2 (điều chế Mg), Al2O3 (điều chế Al),...
2. Điện phân dung dịch chất điện li trong nước
a) Điện phân dung dịch CuSO4 với các điện cực trơ (graphit)
Thí nghiệm cho biết khi suất điện động của nguồn điện bằng hoặc lớn hơn 1,3V, thấy kim loại Cu bám trên catot và khí oxi thoát ra ở anot.
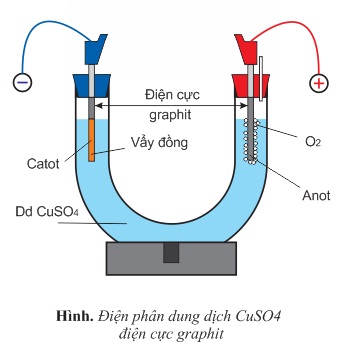
Giải thích: Khi có dòng điện đi vào dung dịch, ion SO2−4 di chuyển về anot, ion Cu2+ di chuyển về catot
- Ở anot (cực + ) có thể xảy ra sự oxi hóa ion SO2−4 hoặc phân tử H2O, vì H2O dễ bị oxi hóa hơn, sản phẩm là khí oxi: 2H2O(l)→O2(k)+4H+(dd)+4e
- Ở catot (cực - ) có thể xảy ra sự khử ion Cu2+ hoặc phân tử H2O. Vì Cu2+ dễ bị khử hơn H2O, nên ion Cu2+ bị khử thành kim loại Cu bám trên catot:
Cu2++2e→Cu
Sơ đồ điện phân:
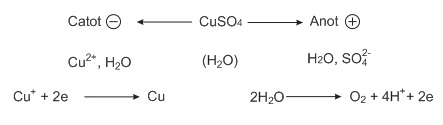
Phương trình điện phân: 2CuSO4+2H2O→đp 2Cu+O2↑+2H2SO4
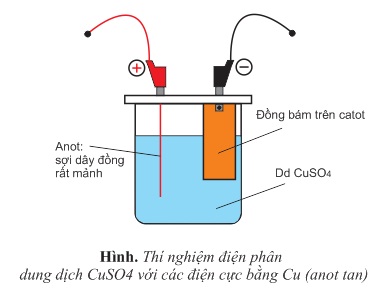
b) Điện phân dung dịch CuSO4 với anot đồng (anot tan)
Khi điện phân dung dịch CuSO4, nếu dùng anot bằng một đoạn dây đồng mảnh (hình dưới) thì sau một thời gian điện phân, đoạn dây đồng nhúng trong dung dịch CuSO4 bị tan hết và có kim loại Cu bám trên bề mặt catot.
Giải thích:
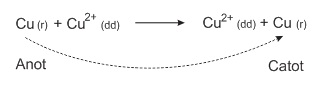
Ở anot (cực +), các nguyên tử Cu bị oxi hóa thành Cu2+ đi vào dung dịch:
Cu(r)→Cu2+(dd)+2e
Trong sự điện phân này, anot dần dần bị hòa tan.
Ở catot (cực -), ion Cu2+ bị khử thành nguyên tử Cu bám trên bề mặt catot:
Cu2+(dd)+2e→Cu(r)
Phương trình điện phân:
Phương trình điện phân cho thấy nồng độ của ion Cu2+ trong dung dịch là không đổi. Sự điện phân này được coi như là sự chuyển dời kim loại Cu từ anot về catot.
III- ỨNG DỤNG CỦA SỰ ĐIỆN PHÂN
Sự điện phân có nhiều ứng dụng trong công nghiệp
1. Điều chế các kim loại
Một số kim loại, dù có thế điện cực chuẩn âm nhưng vẫn có thể điều chế bằng cách điện phân dung dịch muối của chúng. Thí dụ: Hơn 50% sản lượng Zn của thế giới được điều chế bằng phương pháp điện phân dung dịch ZnSO4
Những kim loại có thế điện cực chuẩn rất âm như các kim loại kiềm (Na,K,...) được điều chế bằng cách điện phân những hợp chất ion của chúng ở dạng nóng chảy.
2. Điều chế một số phi kim: như H2,O2,F2,Cl2
3. Điều chế một số hợp chất: như KMnO4,NaOH,H2O2, nước Gia-ven
4. Tinh chế một số kim loại: như Cu,Pb,Zn,Fe,Ag,Au,...
Phương pháp điện phân với anot tan được dùng để tinh chế kim loại. Thí dụ: để có vàng tinh khiết, người ta dùng anot tan là vàng thô, ở catot thu được vàng ròng có độ tinh khiết 99,99%
5. Mạ điện
Điện phân với anot tan cũng được dùng trong kĩ thuật mạ điện, nhằm bảo vệ kim loại khỏi bị ăn mòn và tạo vẻ đẹp cho vật mạ. Trong mạ điện, anot là kim loại dùng để mạ, như Cu,Ag,Au,Cr,Ni,... catot là vật cần mạ. Lớp mạ thường rất mỏng, có độ dày từ 5.10−5 đến 1.10−3cm
Thí dụ: mạ kẽm, thiếc, niken, bạc, vàng,...

.jpg)
.jpg)




.jpg)
.jpg)










