I - AXIT PHOTPHORIC
1. Cấu tạo phân tử
Axit photphoric (H3PO4) có công thức cấu tạo:
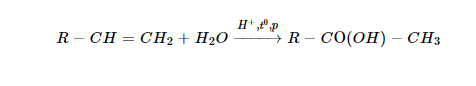
Trong hợp chất H3PO4, photpho có số oxi hóa cao nhất +5.
2. Tính chất vật lí
Axit photphoric, còn gọi là axit orthophotphoric (H3PO4) là chất rắn dạng tinh thể, trong suốt, không màu, nóng chảy ở 42,5oC, rất háo hức nên dễ bị chảy rữa, tan trong nước theo bất kì tỉ lệ nào. Axit photphoric thường dùng là dung dịch đặc, sánh, có nồng độ 85%.
3. Tính chất hóa học
a) Tính oxi hóa - khử
Khác với nitơ, photpho ở mức oxi hóa +5 bền hơn. Do vậy, axit photphoric khó bị khử, không có tính oxi hóa như axit nitric.
b) Tác dụng bởi nhiệt
Khi đun nóng đến khoảng 200−250oC, axit photphoric mất bớt nước, biến thành axit điphotphoric (H4P2O7):
2H3PO4→to H4P2O7+H2O
Tiếp tục đun nóng đến khoảng 400−500oC, axit điphotphoric lại mất bớt nước, biến thành axit metaphotphoric:
H4P2O7→to 2HPO3+H2O
Các axit HPO3,H4P2O7 lại có thể kết hợp với nước để tạo ra axit H3PO4.
c) Tính axit
* Axit H3PO4 là axit ba lần axit, có độ mạnh trung bình. Trong dung dịch nó phân li theo ba nấc. Dưới đây là hằng số phân li axit ở 25oC.
Nấc 1: H3PO4⇌H++H2PO−4;K1=7,6.10−3
Nấc 2: H2PO−4⇌H++HPO2−4;K2=6,2.10−8
Nấc 3: HPO2−4⇌H++PO3−4;K3=4,4.10−13
Sự phân li chủ yếu xảy ra theo nấc 1, nấc 2 yếu hơn và nấc 3 rất yếu. Như vậy trong dung dịch axit photphoric ngoài các phân tử H3PO4 không phân li, còn có các ion H+, đihiđrophotphat (H2PO−4), hiđrophotphat (HPO2−4) và photphat (PO3−4), không kể H+ và OH− do nước phân li ra.
* Dung dịch H3PO4 có những tính chất chung của axit, như làm đổi màu quỳ tím thành đỏ, tác dụng với oxit bazơ, bazơ, muối, kim loại,...
Khi tác dụng với oxit bazơ hoặc bazơ, tùy theo lượng chất tác dụng mà axit photphoric tạo ra muối trung hòa, muối axit hoặc hỗn hợp muối.
Thí dụ: H3PO4+NaOH→NaH2PO4+H2O
H3PO4+2NaOH→Na2HPO4+2H2O
H3PO4+3NaOH→Na3PO4+3H2O
4. Điều chế và ứng dụng
a) Trong phòng thí nghiệm
Axit photphoric được điều chế bằng cách dùng HNO3 đặc oxi hóa photpho:
P+5HNO3(đặc)→to H3PO4+5NO2+H2O
b) Trong công nghiệp
* Cho H2SO4 đặc tác dụng với quặng photphorit hoặc quặng apatit:
Ca3(PO4)2+3H2SO4(đặc) →to 3CaSO4↓+2H3PO4
Tách muối CaSO4 ra và cô đặc dung dịch, rồi làm lạnh để axit kết tinh. Axit photphoric điều chế bằng phương pháp này không tinh khiết, có chất lượng thấp.
* Để điều chế H3PO4 có độ tinh khiết và nồng độ cao hơn, người ta đốt cháy photpho để được P2O5, rồi cho P2O5 tác dụng với nước.
4P+5O2→to 2P2O5
P2O5+3H2O→2H3PO4
Một lượng lớn axit photphoric sản xuất ra được dùng để điều chế các muối photphat và để sản xuất phân lân.
II - MUỐI PHOTPHAT
Muối photphat là muối của axit photphoric. Axit photphoric tạo ra ba loại muối: muối photphat trung hòa và hai muối photphat axit.
Thí dụ: Muối photphat trung hòa: Na3PO4,Ca3(PO4)2,(NH4)3PO4
Muối đihiđrophotphat: NaH2PO4,Ca(H2PO4)2,NH4H2PO4
Muối hiđrophotphat : Na2HPO4,CaHPO4,(NH4)2HPO4
1. Tính chất của muối photphat
a) Tính tan
Tất cả các muối đihiđrophotphat đều tan trong nước.
Trong số các muối hiđrophotphat và photphat trung hòa chỉ có muối natri, kali, amoni là dễ tan, còn muối của các kim loại khác đều không tan hoặc ít tan trong nước.
b) Phản ứng thủy phân
Các muối photphat tan bị thủy phân trong dung dịch.
Thí dụ: Na3PO4+H2O ⇌ Na2HPO4+NaOH
PO3−4+H2O ⇌ HPO2−4+OH−
Do đó, dung dịch Na3PO4 có môi trường kiềm, làm quỳ tím ngả màu xanh.
2. Nhận biết ion photphat
Thuốc thử để nhận biết ion PO3−4 trong dung dịch muối photphat là bạc nitrat.
Thí nghiệm: Nhỏ vào ống nghiệm 5−6 giọt dung dịch Na3PO4 rồi thêm vào đó 3−4 giọt dung dịch AgNO3. Khi đó sẽ tạo thành kết tủa màu vàng, tan được trong dung dịch axit nitric loãng. Phương trình ion rút gọn:
3Ag++PO3−4→Ag3PO4↓
màu vàng

.jpg)
.jpg)




.jpg)
.jpg)










