I. SỰ HÌNH THÀNH LIÊN KẾT CỘNG HOÁ TRỊ
1. Liên kết cộng hoá trị hình thành giữa các nguyên tử giống nhau
Sự hình thành đơn chất
a. Sự hình thành phân tử hidro H2
H : 1s1 và He : 1s2
Sự hình thành phân tử H2 :
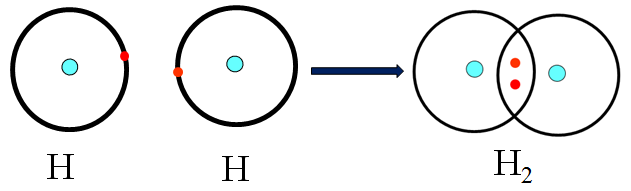
Quy ước
- Mỗi chấm bên kí hiệu nguyên tố biểu diễn 1 electron ở lớp ngoài cùng
- Kí hiệu H : H được gọi là công thức electron , thay 2 chấm (:) bằng 1 gạch (–), ta có H – H gọi là công thức cấu tạo
- Giữa 2 nguyên tử hidro có 1 cặp electron liên kết biểu thị bằng (–) , đó là liên kết đơn
b. Sự hình thành phân tử N2
N : 1s22s22p3
Ne : 1s22s22p6
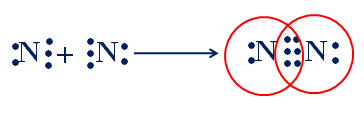
Hai nguyên tử N liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng 3 gạch ( º), đó là liên kết ba. Liên kết 3 bền hơn liên kết đôi.
c. Khái niệm liên kết cộng hoá trị
Định nghĩa : Liên kết cộng hoá trị là liên kết được tạo nên giữa 2 nguyên tử bằng 1 hay nhiều cặp electron dùng chung
- Mỗi cặp electron chung tạo nên 1 liên kết cộng hoá trị, nên ta có liên kết đơn (trong phân tử H2) , liên kết ba (trong phân tử N2)
- Liên kết trong các phân tử H2 , N2 tạo nên từ 2 nguyên tử của cùng 1 nguyên tố (có độ âm điện như nhau) , do đó liên kết trong các phân tử đó không phân cực . Đó là liên kết cộng hoá trị không phân cực
2. Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất
a) Sự hình thành phân tử hidro clorua HCl
Mỗi nguyên tử H và Cl góp 1 electron tạo thành 1 cặp electron chung tạo thành 1 liên kết cộng hoá trị

Kết luận :
* Liên kết cộng hoá trị trong đó cặp eletron chung bị lệch về phía 1 nguyên tử (có độ âm điện lớn hơn) gọi là liên kết cộng hoá trị có cực hay liên kết cộng hoá trị phân cực
*Trong công thức electron của phân tử có cực, người ta đặt cặp electron chung lệch về phía kí hiệu của nguyên tử có độ âm điện lớn hơn
b. Sự hình thành phân tử khí cacbonic CO2 (có cấu tạo thẳng)
C : 1s22s22p2 (2, 4)
O : 1s22s22p4 (2, 6)
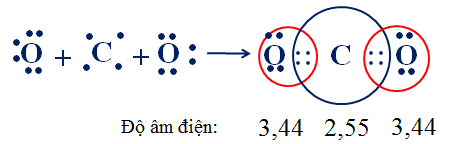
Kết luận : Theo công thức electron, mỗi nguyên tử C hay O đều có 8e ở lớp ngoài cùng đạt cấu hình của khí hiếm nên phân tử CO2 bền vững .
3. Tính chất của các chất có liên kết cộng hoá tr
a. Trạng thái: Các chất mà phân tử chỉ có liên kết cộng hoá trị có thể là :
- Các chất rắn : đường , lưu huỳnh , iot ….
- Các chất lỏng : nước , rượu , xăng , dầu …..
- Các chất khí : khí cacbonic , khí clo , khí hidro …
b.Tính tan:
- Các chất có cực như rượu etylic , đường ,… tan nhiều trong dung môi có cực như nước
- Phần lớn các chất không cực như lưu huỳnh , iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen , cacbon tetra clorua ,…..
· Nói chung các chất có liên kết cộng hoá trị không cực không dẫn điện ở mọi trạng thái
II. ĐỘ ÂM ĐIỆN VÀ LIÊN KẾT HOÁ HỌC
1. Quan hệ giữa liên kết cộng hoá trị không cực, liên kết cộng hoá trị có cực và liên kết ion
a. Trong phân tử, nếu cặp electron chung ở giữa 2 nguyên tử liên kết ta có liên kết cộng hoá trị không cực
b. Nếu cặp electron chung lệch về 1 nguyên tử (có giá trị độ âm điện lớn hơn) thì đó là liên kết cộng hoá trị có cực
c. Nếu cặp electron chung lệch hẳn về 1 nguyên tử , ta sẽ có liên kết ion
2. Hiệu độ âm điện và liên kết hoá học
.png)

.jpg)
.jpg)




.jpg)
.jpg)










