I. KHÁI NIỆM, PHÂN LOẠI, DANH PHÁP
1. Khái niệm, phân loại
- Khi thay thế nguyên tử H trong phân tử NH3 bằng gốc hiđrocacbon ta thu được amin.
- Amin được phân loại theo hai cách thông dụng nhất:
+ Theo gốc hiđrocacbon:
* Amin mạch hở như CH3NH2, C2H5NH2,...,
* Amin thơm như C6H5NH2, CH3C6H4NH2,...
+ Theo bậc của amin (Bậc amin thường được tính bằng số gốc hiđrocacbon liên kết với nguyên tử nitơ):
* Amin bậc một như C2H5NH2
* Amin bậc hai như CH3-NH-CH3
* Amin bậc ba như
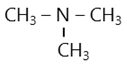
2. Danh pháp
Tên của các amin thường được gọi theo tên gốc - chức (gốc hiđrocacbon với chức amin) và tên thay thế.
II. TÍNH CHẤT VẬT LÝ
- Metylamin, đimetylamin, trimetylamin và etylamin là những chất khí, mùi khai khó chịu, tan nhiều trong nước.
- Các amin có phân tử khối cao hơn là những chất lỏng hoặc rắn, nhiệt độ sôi tăng dần và độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
- Các amin thơm là chất lỏng hoặc chất rắn và dễ bị oxi hóa.
- Các amin đều độc.
III. CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT HÓA HỌC
1. Cấu tạo phân tử
Trong phân tử amin, nguyên tử N tạo được một, hai hoặc ba liên kết với gốc hiđrocacbon, tương ứng có amin bậc một RNH2, amin bậc hai R-NH-R1, amin bậc ba :
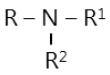
Như vậy, phân tử amin có nguyên tử nitơ tương tự như trong phân tử NH3 nên các amin có tính bazơ. Ngoài ra, amin còn có tính chất của gốc hiđrocacbon.
2. Tính chất hóa học
- Tính bazơ
* Thí nghiệm 1
Nhúng giấy quỳ tím vào dung dịch metylamin hoặc propylamin, màu quỳ tím chuyển thành xanh. Nếu nhúng quỳ tím vào dung dịch anilin, màu quỳ tím không đổi.
Giải thích:
Metylamin và propylamin cũng như nhiều amin khác khi tan trong nước phản ứng với nước tương tự NH3, sinh ra ion OH-.
Thí dụ:
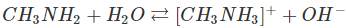
Anilin và các amin thơm khác phản ứng rất kém với nước.
* Thí nghiệm 2
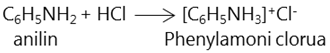
Nhỏ vài giọt anilin vào ống nghiệm đựng nước. Anilin hầu như không tan và lắng xuống đáy ống nghiệm. Nhỏ vài giọt anilin vào ống nghiệm đựng dung dịch HCl, thấy anilin tan. Đó là do anilin có tính bazơ, tác dụng với axit:
Các amin tan nhiều trong nước như metylamin, etylamin,... có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein, có lực bazơ mạnh hơn amoniac nhờ ảnh hưởng của nhóm ankyl.
Anilin có tính bazơ, nhưng dung dịch của nó không làm xanh giấy quỳ tím, cũng không làm hồng phenolphtalein vì lực bazơ của nó rất yếu và yếu hơn amoniac. Đó là do ảnh hưởng của gốc phenyl (tương tự phenol). Như vậy, có thể so sánh lực bazơ như sau:
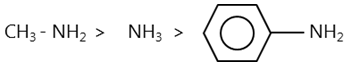
- Phản ứng thế ở nhân thơm của anilin
* Thí nghiệm: Nhỏ vài giọt nước brom vào ống nghiệm đã đựng sẵn 1 ml anilin, thấy trong ống nghiệm xuất hiện kết tủa trắng.
* Giải thích: Do ảnh hưởng của nhóm NH2, ba nguyên tử H ở các vị trí ortho và para so với nhóm NH2 trong nhân thơm của anilin dễ bị thay thế bởi ba nguyên tử brom:
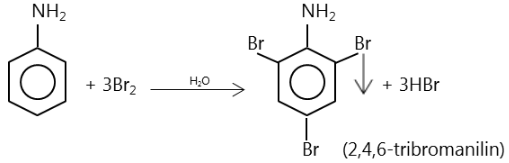
Phản ứng này dùng để nhận biết anilin.

.jpg)
.jpg)




.jpg)
.jpg)










