I- ĐỊNH NGHĨA, PHÂN LOẠI, DANH PHÁP
1. Định nghĩa
Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (−COOH liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro).
Nhóm 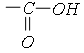 được gọi là nhóm cacboxyl, viết gọn là −COOH.
được gọi là nhóm cacboxyl, viết gọn là −COOH.
2. Phân loại
* Nếu nhóm cacboxyl liên kết trực tiếp với nguyên tử hiđro hoặc gốc ankyl thì tạo thành dãy axit no, mạch hở, đơn chức, công thức chung là CnH2n+1COOH, gọi là dãy đồng đẳng của axit fomic (HCOOH), thí dụ: CH3COOH (axit axetic), CH3CH2COOH (axit propionic),...
* Nếu gốc hiđrocacbon trong phân tử axit có chứa liên kết đôi, liên kết ba thì gọi là axit không no, thí dụ : CH2=CHCOOH,CH≡C−COOH,...
* Nếu gốc hiđrocacbon là vòng thơm thì gọi là axit thơm, thí dụ: C6H5−COOH (axit benzoic),...
* Nếu trong phân tử có nhiều nhóm cacbonyl (−COOH ) thì gọi là axit đa chức, thí dụ: HOOC−COOH (axit oxalic), HOOCCH2COOH (axit malonic),...
3. Danh pháp
Theo IUPAC, tên của axit cacboxylic mạch hở chứa không quá 2 nhóm cacboxyl được cấu tạo bằng cách đặt từ axit trước tên của hiđrocacbon tương ứng theo mạch chính (mạch chính bắt đầu từ nguyên tử C của nhóm −COOH) rồi thêm vào đó đuôi oic.
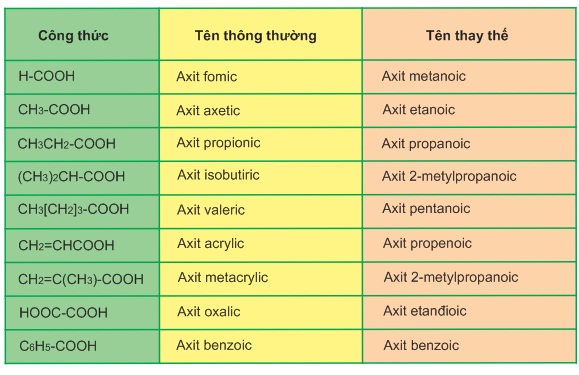
Tên thông thường của các axit có liên quan đến nguồn gốc tìm ra chúng nên không có tính hệ thống (bảng 9.1)
Bảng 9.1. Tên một số axit thường gặp
II - CẤU TRÚC VÀ TÍNH CHẤT VẬT LÍ
1. Cấu trúc
Nhóm −COOH được hợp bởi nhóm cacbonyl (>C=O) và nhóm hiđroxyl (−OH) vì thế nó được gọi là nhóm cacboxyl. Tương tác giữa nhóm cacbonyl và nhóm hiđroxyl làm cho mật độ electron ở nhóm cacboxyl dịch chuyển như biểu diễn bởi mũi tên ở hình 9.2a
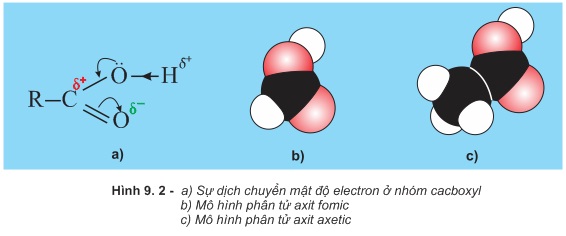
Hệ quả là nguyên tử hiđro ở nhóm −OH axit trở nên linh động hơn ở nhóm −OH ancol, phenol và phản ứng của nhóm >C=O axit cũng không còn giống như của nhóm >C=O anđehit, xeton.
2. Tính chất vật lí
Ở điều kiện thường, tất cả các axit cacboxylic đều là những chất lỏng hoặc rắn. Điểm sôi của các axit cacboxylic cao hơn của anđihit, xeton và cả ancol có cùng số nguyên tử cacbon. Nguyên nhân là do sự phân cực ở nhóm cacboxyl (hình 9.2a) và sự tạo thành liên kết hiđro liên phân tử ở axit cacboxylic. (hình 9.3)
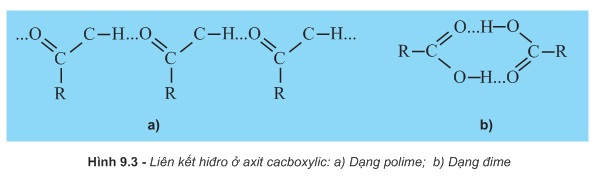
Axit cacboxylic cũng tạo liên kết hiđro với nước và nhiều chất khác. Các axit fomic, axetic, propionic tan vô hạn trong nước. Khi số nguyên tử C tăng lên thì độ tan trong nước giảm.
Mỗi axit cacboxylic có vị chua riêng biệt, thí dụ axit axetic có vị chua của giấm, axit xitric có vị chua chanh, axit oxalic có vị chua của me, axit tactric có vị chua của nho ,..

.jpg)
.jpg)




.jpg)
.jpg)










