I- TÍNH CHẤT VẬT LÝ VÀ TRẠNG THÁI TỰ NHIÊN
Saccarozơ là chất kết tinh, không màu, vị ngọt, dễ tan trong nước, nóng chảy ở 185oC.
Saccarozơ có trong nhiều loại thực vật và là thành phần chủ yếu của đường mía (từ cây mía); đường củ cải (từ củ cải đường); đường thốt nốt (từ cụm hoa thốt nốt).
Ở nước ta, đường mía được sản xuất dưới nhiều dạng thương phẩm khác nhau: đường phèn là đường mía kết tinh ở nhiệt độ thường (khoảng 30oC) dưới dạng tinh thể lớn. Đường cát là đường mía kết tinh có lẫn tạp chất màu vàng. Đường phên là đường mía được ép thành phên, còn chứa nhiều tạp chất, có màu nâu sẫm. Đường kính chính là saccarozơ ở dạng tinh thể nhỏ.
II- CẤU TRÚC PHÂN TỬ
Saccarozơ có công thức phân tử là C12H22O11. Người ta xác định cấu trúc phân tử saccarozơ căn cứ vào các dữ kiện thí nghiệm sau:
- Dung dịch saccarozơ hòa tan Cu(OH)2 thành dung dịch màu xanh lam, chứng tỏ trong phân tử saccarozơ có nhiều nhóm OH gần nhau.
- Dung dịch saccarozơ không có phản ứng tráng bạc, không bị oxi hóa bởi nước brom, chứng tỏ phân tử saccarozơ không có nhóm CH=O
- Đun nóng dung dịch saccarozơ có mặt axit vô cơ làm xúc tác, ta đun saccarozơ và fructozơ
Các dữ kiện thực nghiệm khác cho phép xác định được trong phân tử saccarozơ gốc α-glucozơ và gốc β-fructozơ liên kết với nhau qua nguyên tử oxi giữa C1 của glucozơ và C2 của fructozơ (C1−O−C2). Liên kết này thuộc loại liên kết glicozit. Vậy cấu trúc phân tử saccarozơ được biểu diễn như sau:

gốc α-glucozơ gốc β-fructozơ
III- TÍNH CHẤT HÓA HỌC
Saccarozơ không có tính khử vì phân tử không còn nhóm OH hemiaxetal tự do nên không chuyển được thành dạng mạch hở chứa anđehit. Vì vậy, saccarozơ chỉ còn tính chất của ancol đa chức và có phản ứng thủy phân của đisaccarit.
1. Phản ứng với Cu(OH)2
Thí nghiệm: Cho vào một ống nghiệm vài giọt dung dịch CuSO45%, sau đó thêm tiếp 1ml dung dịch NaOH10%. Gạn bỏ phần dung dịch, giữ lại kết tủa Cu(OH)2, thêm khoảng 2 ml dung dịch saccarozơ 1%, sau đó lắc nhẹ.
Hiện tượng: Kết tủa Cu(OH)2 tan trong dung dịch saccarozơ cho dung dịch màu xanh lam.
Giải thích: Là một poliol có nhiều nhóm OH kề nhau nên saccarozơ đã phản ứng với Cu(OH)2 sinh ra phức đồng-saccarozơ tan có màu xanh lam.
2C12H22O11+Cu(OH)2→(C12H21O11)2Cu+2H2O
2. Phản ứng thủy phân
Dung dịch saccarozơ không có tính khử nhưng khi đun nóng với axit thì tạo thành dung dịch có tính khử là do nó bị thủy phân thành glucozơ và fructozơ:
C12H22O11+H2O→( H+,to) C6H12O6+C6H12O6
saccarozơ glucozơ fructozơ
Trong cơ thể người, phản ứng này xảy ra nhờ enzim.
IV- ỨNG DỤNG VÀ SẢN XUẤT ĐƯỜNG SACCAROZƠ
1. Ứng dụng
Saccarozơ được dùng nhiều trong công nghiệp thực phẩm, để sản xuất công nghiệp thực phẩm, để sản xuất bánh kẹo, nước giải khát,...Trong công nghiệp dược phẩm để pha chế thuốc.
2. Sản xuất đường saccarozơ
Sản xuất đường từ cây mía qua một số công đoạn chính thể hiện ở sơ đồ dưới đây
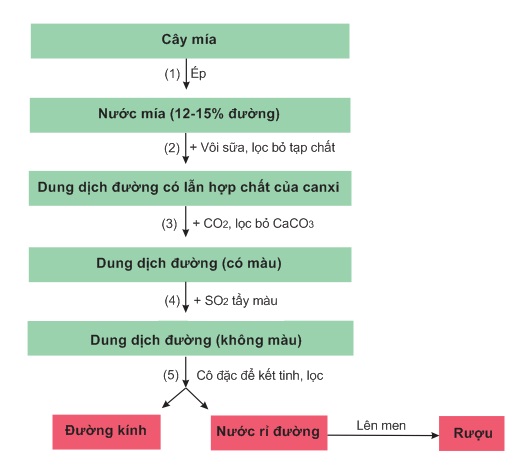
V- ĐỒNG PHÂN CỦA SACCAROZƠ: MANTOZƠ
Trong số các đồng phân của saccarozơ, quan trọng nhất là mantozơ (còn gọi là đường mạch nha). Công thức phân tử C12H22O11
Ở trạng thái tính thể, phân tử mantozơ gồm hai gốc glucozơ liên kết với nhau ở C1 của gốc α-glucozơ này với C4 của gốc α-glucozơ kia qua một nguyên tử oxi. Liên kết α−C1−O−C4 như thế được gọi là liên kết α−1,4−glicozit. Trong dung dịch, gốc α−glucozơ của mantozơ có thể mở vòng tạo ra nhóm CH=O:
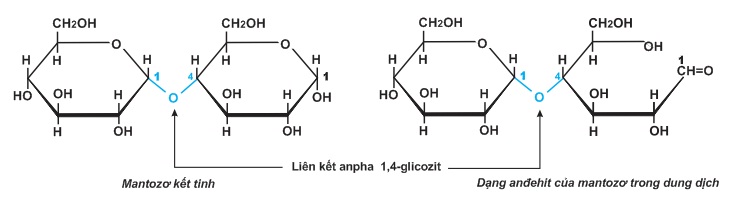
Do cấu trúc như trên, mantozơ có 3 tính chất chính:
1. Tính chất của poliol giống saccarozơ: tác dụng với (OH)2 cho phức đồng-mantozơ màu xanh.
2. Tính khử tương tự glucozơ, thí dụ: Khử [Ag(NH3)2]OH và Cu(OH)2 khi đun nóng. Mantozơ thuộc loại đisaccarit có tính khử.
3. Bị thủy phân khi có mặt xúc tác axit hoặc enzim sinh ra 2 phân tử glucozơ.
Mantozơ được điều bằng cách thủy phân tinh bột nhờ enzim amilaza (có trong mầm lúa). Phản ứng thủy phân này cũng xảy ra trong cơ thể người và động vật.

.jpg)
.jpg)




.jpg)
.jpg)










