I- ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP, TÍNH CHẤT VẬT LÍ VÀ CẤU TRÚC
1. Đồng đẳng , đồng phân, danh pháp
Ankin là những hiđrocacbon mạch hở có 1 liên kết ba trong phân tử.
Ankin đơn giản nhất, C2H2:(HC≡CH), có tên thông thường là axetilen.
Dãy đồng đẳng của axetilen có công thức chung là CnH2n−2 (n≥2, với một liên kết ba). Thí dụ: HC≡CH,CH3−C≡CH,...
Ankin từ C4 trở đi có đồng phân vị trí nhóm chức, từ C5 trở đi có thêm đồng phân mạch cacbon.
Theo IUPAC, quy tắc gọi tên ankin tương tự như gọi tên anken, nhưng dùng đuôi in để chỉ liên kết ba (xem bảng 6.2).
2. Tính chất vật lí
Nhiệt độ sôi, nhiệt độ nóng chảy, khối lượng riêng của một số ankin được liệt kê ở bảng 6.2
Bảng 6.2. Tên thay thế và tính chất vật lí của một số ankin

3 Cấu trúc phân tử
Trong phân tử ankin, hai nguyên tử C liên kết ba ở trạng thái lai hóa sp (lai hóa đường thẳng). Liên kết ba C≡C gồm 1 liên kết σ và 2 liên kết π. Hai nguyên tử C mang liên kết ba và 2 nguyên tử liên kết trực tiếp với chúng nằm trên một đường thẳng.
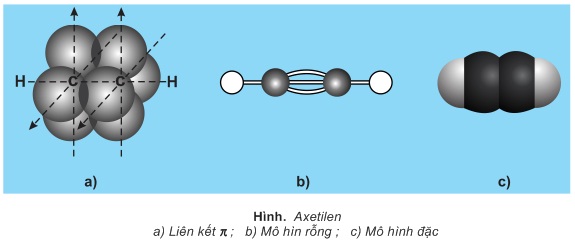
II- TÍNH CHẤT HÓA HỌC
1. Phản ứng cộng
a) Cộng hiđro
Khi có xúc tác Ni,Pt,Pd ở nhiệt độ thích hợp, ankin cộng với H2 tạo thành ankan:
CH≡CH+2H2→Ni,to CH3−CH3
Muốn dừng lại ở giai đoạn tạo ra anken thì phải dùng xúc tác là hỗn hợp Pd với PdCO3:
CH≡CH+H2→(Pd/PbCO3)CH2=CH2
b) Cộng brom
Giống như anken, ankin làm mất màu nước brom, phản ứng xảy ra qua hai giai đoạn. Muốn dừng lại ở giai đoạn thứ nhất thì cần thực hiện phản ứng ở nhiệt độ thấp, thí dụ:
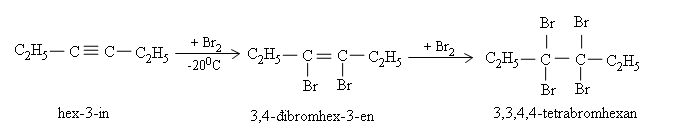
c) Cộng hiđro clorua
CH≡CH+HCl→ (150−200oCHgCl2) CH2=CH−Cl(vinylclorua)
CH2=CH−Cl+HCl→CH3−CHCl2(1,1−đicloetan)
d) Cộng nước (hiđrat hóa)
Khi có mặt xúc tác HgSO4 trong môi trường axit, H2O cộng vào liên kết ba tạo ra hợp chất trung gian không bền và chuyển thành anđehit hoặc xeton, thí dụ:
HC≡CH+H−OH→ (80oC HgSO4,H2SO4) [CH2=CH−OH]→CH3−CH=O
etin (không bền) anđehit axetic
Phản ứng cộng HX,H2O vào các ankin trong dãy đồng đẳng của axetilen cũng tuân theo quy tắc Mac-côp-nhi-côp như anken.
e) Phản ứng đime hóa và trime hóa
Hai phân tử axetilen có thể cộng hợp với nhau tạo thành vinylaxetilen:
Ba phân tử axetilen có thể cộng hợp với nhau thành benzen:
2CH≡CH→xt,to CH2=CH−C≡CH
vinylaxetilen
3CH≡CH→xt,to C6H6
2. Phản ứng thế bằng ion kim loại
Nguyên tử H đính vào cacbon mang liên kết ba linh động hơn rất nhiều so với H đính với cacbon mang liên kết đôi và liên kết đơn, do đó nó có thể bị thay thế bằng nguyên tử kim loại. Thí dụ, khi cho axetilen sục vào dung dịch AgNO3 trong amoniac thì xuất hiện kết tủa màu vàng nhạt sau chuyển sang màu xám:
AgNO3+3NH3+H2O→[Ag(NH3)2]OH+NH4NO3
(phức chất, tan trong nước)
HC≡CH+2[Ag(NH3)2]OH→Ag−C≡C−Ag↓+2H2O+4NH3
(kết tủa màu vàng nhạt)
Phản ứng này không những dùng để nhận ra axetilen mà cả các ankin có nhóm H−C≡C− (các ankin mà liên kết ba ở đầu mạch):
R−C≡C−H+[Ag(NH3)2]OH→R−C≡C−Ag↓+H2O=2NH3
(kết tủa màu vàng nhạt)
3. Phản ứng oxi hóa
Các ankin cháy trong không khí tạo ra CO2,H2O và tỏa nhiều nhiệt:
CnH2n−2+3n−1/2 O2→nCO2+(n−1)H2O;ΔH<0
Giống như anken, ankin làm mất màu dung dịch KMnO4. Khi đó nó bị oxi hóa ở liên kết ba tạo ra hỗn hợp các sản phẩm phức tạp, còn KMnO4 thì bị khử thành MnO2 (kết tủa màu nâu đen).
III - ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế
* Phương pháp chính điều chế axetilen trong công nghiệp hiện nay là nhiệt phân metan ở 15000C, phản ứng thu nhiệt mạnh:
2CH4→1500oC CH≡CH+3H2
Nhiệt độ sôi của axetilen là −750C nên dễ được tách ra khỏi hỗn hợp với hiđro.
* Ở những nơi mà công nghiệp dầu khí chưa phát triển, người ta điều chế axetilen theo sơ đồ sau:
CaO+3C→ (-COlòđiện) CaC2→(H2O) Ca(OH)2+C2H2
Canxi cacbua sản xuất trong công nghiệp (từ vôi sống và than đá) là chất rắn, màu đen xám, trước kia được dùng tạo ra C2H2 để thắp sáng, vì vậy nó được gọi lá " đất đèn". Ngày nay, để điều chế một lượng nhỏ axetilen trong phòng thí nghiệm hoặc trong hàn xì, người ta vẫn thường dùng đất đèn. Axetilen điều chế từ đất đèn thường có tạp chất (H2S,NH3,PH3,...) có mùi khó chịu gọi là mùi đất đèn.
2. Ứng dụng
Axetilen cháy trong oxi tạo ra ngọn lửa có nhiệt độ khoảng 30000C nên được dùng trong đèn xì axetilen - oxi để hàn và cắt kim loại:
C2H2+5/2 O2→2CO2+H2O;ΔH=−1300kJ
Sử dụng axetilen phải rất cẩn trọng vì khi nồng độ axetilen trong không khí từ 2,5% trở lên có thể gây cháy nổ.
Axetilen và các ankin khác còn được dùng làm nguyên liệu để tổng hợp các hóa chất cơ bản khác như vinyl clorua, vinyl axetat, vinylaxetilen, anđehit axetic,...

.jpg)
.jpg)




.jpg)
.jpg)










