I - KHÁI NIỆM VỀ LIÊN KẾT KIM LOẠI
Hầu hết các kim loại ở điều kiện thường đều tồn tại dưới dạng tinh thể (trừ Hg). Trong tinh thể kim loại, ion dương và nguyên tử kim loại ở những nút của mạng tinh thể. Các electron hóa trị liên kết yếu với hạt nhân nên dễ tách khỏi nguyên tử và chuyển động tự do trong mạng tinh thể. Lực hút giữa các electron này và các ion dương tạo nên liên kết kim loại.
Như vậy: Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
II - MẠNG TINH THỂ KIM LOẠI
1. Một số kiểu mạng tinh thể
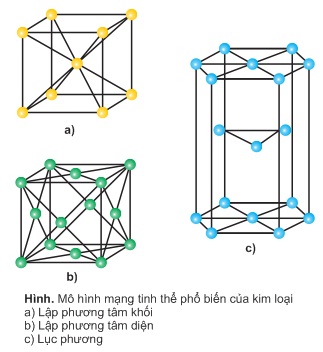
Các kim loại tồn tại dưới ba dạng tinh thể phổ biến sau:
Lập phương tâm khối: Các nguyên tử, ion kim loại nằm trên đỉnh và tâm của hình lập phương.
Lập phương tâm diện: Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương.
Lục phương: Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các hình lục giác đứng và ba nguyên tử, ion nằm phía trong của hình lục giác.
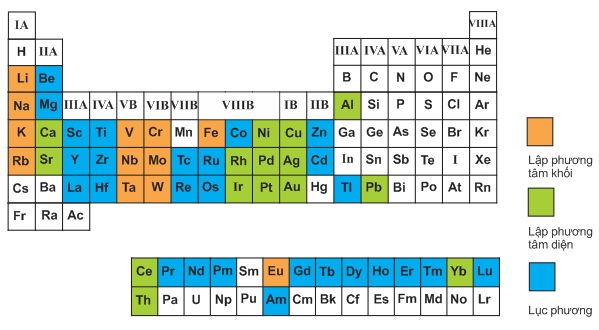
Kết cấu trúc mạng tinh thể phổ biến của một số kim loại được tổng kết trong bảng 3.1. Chúng ta có thể tra cứu khi muốn biết kim loại nghiên cứu có kiểu mạng tinh thể nào.
Thí dụ: Từ bảng 3.1 cho thấy kim loại sắt thuộc dạng tinh thể lập phương tâm khối, đồng dạng thuộc tinh thể lập phương tâm diện và coban thuộc dạng tinh thể lục phương. Người ta dùng độ đặc khít ρ là phần trăm thể tích mà các nguyên tử chiếm trong tinh thể để đặc trưng cho từng kiểu cấu trúc. Với kiểu cấu trúc lập phương tâm khối, ρ=68%; Kiểu cấu trúc lục phương tâm diện, ρ=74%; Kiểu cấu trúc lập phương, ρ=74%. Phần trăm cón lại trong tinh thể là không gian trống.
Thí dụ: Đối với các kim loại có cấu trúc kiểu lập phương tâm khối, các nguyên tử kim loại chiếm 68% thể tích của tinh thể. Không gian trống của tinh thể là 32% thể tích tinh thể.
Bảng 3.1
Kiểu cấu trúc mạng tinh thể phổ biến của một số kim loại trong bảng tuần hoàn
2. Tính chất của tinh thể kim loại.
Vì trong tinh thể kim loại có những electron tự do, di chuyển được trong mạng nên tinh thể kim loại có những tính chất cơ bản sau: Có ánh kim, dẫn điện, dẫn nhiệt tốt và có tính dẻo.

.jpg)
.jpg)




.jpg)
.jpg)










