I. HIDRO CLORUA
1. Cấu tạo phân tử: ![]() hay H -Cl
hay H -Cl
Hidro clorua là hợp chất cộng hóa trị, phân tử có cực ( hiệu độ âm điện giữa nguyên tử clo và nguyên tử hidro : 3,16-2,20= 0,96)
2. Tính chất
- Hiđroclorua là chất khí, không màu, tan nhiều trong nước (1lít nước hòa tan 500 lít HCl)
- Hiđroclorua nặng hơn không khí
- Khí HCl không làm quì tim (khô) hóa đỏ
- Khí HCl không tác dụng với CaCO3,...
- Dung dịch thu được là axit nên làm dung dịch quỳ tím ngả sang màu đỏ. Vậy, khí HCl tan rất nhiều trong
nước. Người ta xác định được ở 20oC, một thể tích nước có thể hòa tan tới gần 500 thể tích khí HCl.
II. AXIT CLOHIDRIC
1. Tính chất vật lí
Axit clohiđric là chất lỏng không màu, mùi xốc.
HCl đặc C% ≈ 37% và D = 1,19(g/ml)
HCl đặc bốc khối trong không khí ẩm.
2. Tính chất hóa học
Axit clohiđric là axit mạnh có đầy đủ tính chất của một axit: là làm đổi màu quỳ, tác dụng với kim loại đứng
trước Hidro, tác dụng với bazơ, oxit bazơ tạo muối + nước và tác dụng được với muối.
Ví dụ:
2HCl + Fe → FeCl2 + H2
2HCl + CuO → CuCl2 + H2O
3HCl + Fe(OH)3 → FeCl3 + 3H2O
2HCl + CaCO3 → CaCl2 + CO2 + H2O
Tính khử của HCl
Trong phân tử HCl, nguyên tử clo có số oxi hóa là -1 dễ bị oxi hóa lên Cl2.
MnO2 + 4HCl → MnCl2 + Cl2 + H2O
3. Điều chế
rong phòng thí nghiệm
NaCl + H2SO4 →(t <250oC) NaHSO4 + HCl
2NaCl + H2SO4 →(t > 400oC) Na2SO4 + 2HCl
Trong công nghiệp
Phương pháp sunfat : từ NaCl và H2SO4 đậm đặc.
Phương pháp tổng hợp : Từ H2 và Cl2 , đốt Cl2 và H2 lấy từ phương trình điện phân dung dịch NaCl
H2 + Cl2 → 2HCl
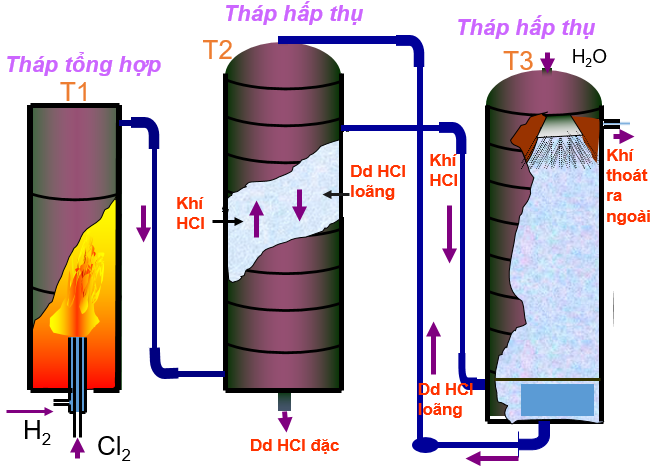
Phương pháp clo hoá các chất hữu cơ: C2H6 + Cl2 → C2H5Cl +HCl
III. MUỐI CLORUA VÀ NHẬN BIẾT ION CLORUA
1. Một số muối clorua
Muối clorua là muối của axit clohiđric.
Đa số muối clorua đều dễ tan trong nước, một vài muối không tan : AgCl, PbCl2 (không tan trong nước lạnh, tan khá nhiều trong nước nóng), CuCl, HgCl2
Một số muối clorua dễ bay hơi ở nhiệt độ cao như Cu(II) clorua, sắt(III) clorua, thiếc(IV) clorua…
2. Nhận biết ion clorua
AgNO3 + NaCl → AgCl↓ + NaNO3
AgNO3 + HCl→ AgCl↓ + HNO3
→ Kết luận : Dung dịch AgNO3 là thuốc thử để nhận biết ion clorua.

.jpg)
.jpg)




.jpg)
.jpg)










