A. SILIC
Cấu hình electron của Si: 1s22s22p63s23p2.
Silic ở ô thứ 14, nhóm IV A, chu kì 3 của bảng tuần hoàn
I. TÍNH CHẤT VẬT LÝ
- Silic gồm có : Silic tinh thể và vô định hình
- Silic tinh thể có cấu trúc giống kim cương, màu xám, ánh kim, có tính bán dẫn, nóng chảy ở 1420oC
- Silic vô định hình là chất bột màu nâu
- Silic có tính chất vật lí của nguyên tố nửa kim loại.
II. TÍNH CHẤT HÓA HỌC
Số oxi hóa của Si giống C: -4, 0, +2, +4
Vừa có tính khử, vừa có tính oxy hoá.
1. Tính khử
a) Tác dụng với phi kim
- Với Flo ở đều kiện thường: Si + 2F2 → SiF4
- Với halogen, O2: ở nhiệt độ cao
Si + O2 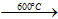 SiO2
SiO2
b) Tác dụng với hợp chất:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
2. Tính oxi hoá
Khi tác dụng với kim loại ở nhiệt độ cao tạo các silixua kim loại
Si + 2Mg .png) Mg2Si (Magie silixua)
Mg2Si (Magie silixua)
III. TRẠNG THÁI TỰ NHIÊN

Tinh thể thạch anh
- Silic là nguyên tố phổ biến thứ hai sau Oxi, chiếm gần 29,5% khối lượng Vỏ Trái Đất.
- Trong tự nhiên không có Silic tự do, mà chỉ gặp được ở dạng hợp chất: chủ yếu silic đioxit; các khoáng vật silicat; cao lanh, thạch anh, ...
IV. ỨNG DỤNG
Silic siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật

Ứng dụng của Silic
V. ĐIỀU CHẾ
Nguyên tắc:
Dùng chất khử mạnh (Mg, Al, C…) khử SiO2 ở nhiệt độ cao
SiO2 + 2Mg .png) Si + 2MgO
Si + 2MgO
B. HỢP CHẤT CỦA SILIC
I. SILIC DIOXIT
- Silic đioxit là chất ở dạng tinh thể, nóng chảy ở 1713oC, không tan trong nước.
- Oxít axít nên tác dụng kiềm đặc nóng hoặc nóng chảy.
SiO2 + 2NaOH ![]() Na2SiO3 + H2O.
Na2SiO3 + H2O.
SiO2 tan được trong HF.
SiO2 + 4HF → SiF4 + 2H2O
→ Dung dịch HF dùng để khắc chữ và hình trên thuỷ tinh.
II. AXIT SILIXIT (H2SiO3)
- Kết tủa keo: Không tan trong nước.
- Dễ mất nước khi đun nóng
- Là axít yếu, yếu hơn cả H2CO3: Phương trình Na2SiO3 + CO2 + H2O → H2SiO3↓ + Na2CO3
III. MUỐI SILICAT
Đa số muối silicat không tan.
Chỉ có muối silicat của Kim loại kiềm tan trong H2O.

.jpg)
.jpg)




.jpg)
.jpg)










