I. THÀNH PHẦN CẤU TẠO NGUYÊN TỬ
1.Electron
a. Sự tìm ra electron
Năm 1897, J.J. Thomson (Tôm-xơn, người Anh ) đã tìm ra tia âm cực gồm những hạt nhỏ gọi là electron(e).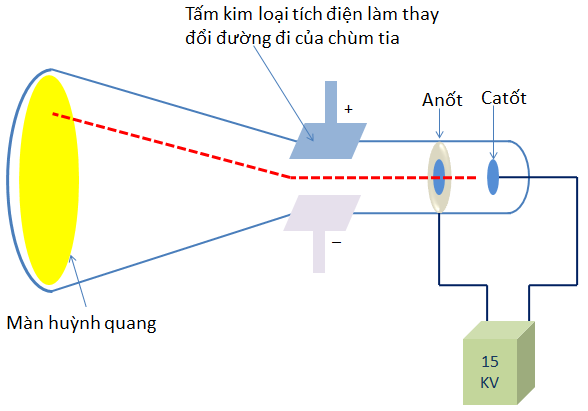
Sơ đồ thí nghiệm của Tôm-xơn phát hiện ra tia âm cực
Kết luận:
- Tia âm cực là chùm hạt vật chất có khối lượng và chuyển động với vận tốc rất lớn.
- Tia âm cực là chùm hạt mang điện âm,phát ra từ cực âm ,các hạt tạo thành tia âm cực được gọi là các electron (ký hiệu là e).
- Electron có mặt ở mọi chất, electron tạo nên lớp vỏ nguyên tử của mọi nguyên tố hóa học.
- Tia âm cực bị lệch trong từ trường và mang điện tích âm.
b, Khối lượng, điện tích electron
me = 9,1094.10-31kg.
qe = -1,602.10-19 C (coulomb)
2. Sự tìm ra hạt nhân nguyên tử
- Năm 1911, nhà vật lí người Anh Rutherford và các cộng sự cho các hạt a bắn phá một lá vàng mỏng.
- Từ đó nhận thấy nguyên tử có đặc điểm:
Cấu tạo rỗng
Chứa phần mang điện tích dương, được gọi là hạt nhân
Kích thước của hạt nhân rất nhỏ so với kích thước của nguyên tử
- Kết luận:
Nguyên tử cấu tạo gồm hạt nhân và lớp vỏ nguyên tử (chứa các electron).
Do nguyên tử trung hòa về điện nên số đơn vị điện tích dương của hạt nhân bằng đúng số electron quay xung quanh hạt nhân.
Khối lượng nguyên tử xấp xỉ khối lượng hạt nhân.
3. Cấu tạo của hạt nhân nguyên tử
a. Sự tìm ra hạt proton.
Năm 1918, hạt proton được tìm ra có:
Khối lượng: mp = 1,6726.10-27 kg
oĐiện tích: qp = + 1,6.10-19 C = eo
Hạt proton là một thành phần cấu tạo của hạt nhân nguyên tử. Quy ước: 1+
b) Sự tìm ra hạt nơtron
Năm 1932, Chadwick tìm ra hạt nơtron có:
Khối lượng: mn ≈ mp = 1,6748.10-27 kg
Điện tích: qn = 0
Hạt notron là một thành phần cấu tạo của hạt nhân nguyên tử.
II. KÍCH THƯỚC VÀ KHỐI LƯỢNG NGUYÊN TỬ
1. Kích thước
Để biểu thị kích thước nguyên tử người ta dùng đơn vị nanomet(nm) hay angstrom Å
1 nm = 10-9m ; 1Ao = 10-10m ; 1nm = 10Ao
Nguyên tử nhỏ nhất là nguyên tử Hidro có bán kính khoảng 0,053 nm
Đường kính của hạt nhân nguyên tử còn nhỏ hơn (vào khoảng 10-5 nm)
Đường kính của electron và proton còn nhỏ hơn nhiều ( vào khoảng 10-8 nm)
2. Khối lượng nguyên tử
Do khối lượng thật của 1 nguyên tử quá bé, người ta dùng đơn vị khối lượng nguyên tử u (đvC).
1 u = 1/12 khối lượng 1 nguyên tử đồng vị cacbon 12 = 1,6605.10-27kg.
m nguyên tử = mP + mN (Bỏ qua me)

Khối lượng và điện tích của các hạt tạo nên nguyên tử

.jpg)
.jpg)




.jpg)
.jpg)










