1. Pin Li - Ion là gì?
Pin Li-ion(Pin lithium-ion) là một trong những loại pin có thể sạc nhiều lần. Loại pin này cho phép các ion chuyển động từ điện cực âm sang điện cực dương trong quá trình dùng và ngược lại khi sạc.
Qua thời gian dài nghiên cứu và ứng dụng loại pin này đang dần được cải thiện về khả năng tích trữ năng lượng cũng như độ bền theo thời gian. Theo như lý thuyết thì quá trình di chuyển của các hạt điện tích không bao giờ ngừng lại và chúng ta sẽ có được viên pin sử dụng trong thời gian dài mà không hư hỏng.

Pin Li - ion
2. Cấu tạo và nguyên lý hoạt động của Pin Li - ion:
a. Cấu tạo pin lithium ion:
- Điện cực dương
Cực dương hay còn được gọi là Cathode được làm từ Lithium Cobalt Oxide (LiCoO2). Cực dương có cấu trúc phân tử bao gồm Oxide Coban được liên kết với các nguyên tử Lithium. Khi có bất cứ dòng điện này chạy qua cực dương thì các nguyên tử Lithium này sẽ tách khỏi cấu trúc vào tạo thành ion Li+.
- Điện cực âm
Cực âm hay còn được gọi là Negative được cấu tạo từ than chì (graphene). Cực âm này sẽ có chức năng là giữ các ion Lithium Li+ từ cực dương di chuyển qua trong tinh thể của mình.
- Dung dịch điện ly
Dung dịch điện ly hay còn gọi là dung dịch điện phân là một loại chất lỏng được lấp đầy giữa cực âm, cực dương và màng ngăn. Dung dịch này có chứa LiPF6 và các dung môi hữu cơ và chứa rất ít thành phần nước vì có thể gây ra phản ứng giữa Li+ và nước. Dung dịch điện phân này sẽ có tác dụng dẫn các ion Li+ di chuyển qua lại giữa 2 cực của pin.
Các lá dài của pin sẽ được quấn lại để tạo thành nhiều vòng, các vòng này sẽ được ép chặt lại với nhau, ở giữa các vòng sẽ là dung dịch điện phân. Lớp vỏ bên ngoài của pin sẽ thường được làm bằng chất liệu kim loại để có thể nén chặt các lớp vật liệu ở bên trong. Pin Li- ion còn được trang bị thêm các lỗ thoát khí để tránh cho pin bị nổ khi áp suất ở bên trong tăng lên cao.
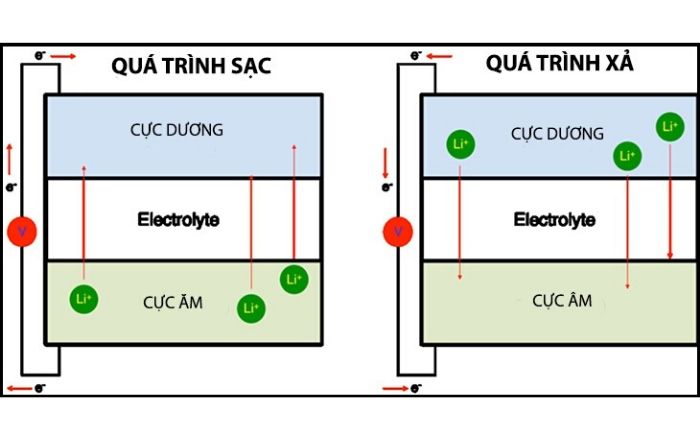
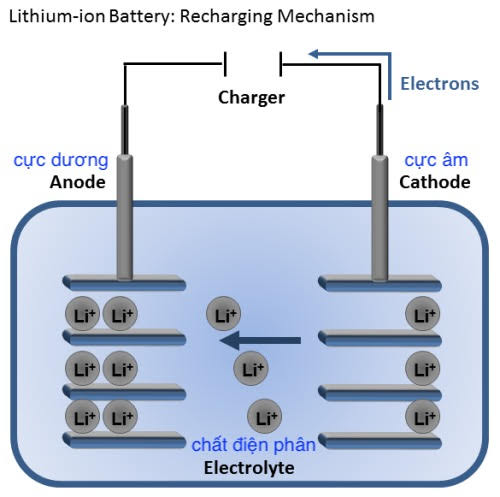
b. Nguyên lý hoạt động của Pin Li ion:
Bản chất trong một viên pin là sự di chuyển của các hạt điện tích giữa hai cực âm và dương. Khi viên pin được xả hoàn toàn, điện tích chủ yếu chứa trong viên pin sẽ là điện tích dương và không thể sử dụng để cung cấp cho các phần cứng yêu cầu trong thiết bị.
Sau khi ta cắm điện, quá trình nạp lại điện tích diễn ra, viên pin sẽ được cung cấp lại điện tích âm thiếu hụt trong quá trình sử dụng. Khi số lượng điện tích đã bão hòa tức là pin đã đầy. Và cứ như vậy quá trình nạp xả của một viên pin.
3. Ưu và nhược điểm của Pin Li - ion
a. Ưu điểm
- Nếu so với các pin thông thường, thì Pin Li-ion có thể cho việc sử dụng lâu hơn với cùng một kích thước pin.
- Ngoài ra, với việc thiết kế bằng các chất điện phân dạng lỏng, nên chi phí sản xuất pin Li-ion khá rẻ, phù hợp cho nhiều thiết bị khác nhau.
b. Nhược điểm
- Vì chất điện phân hữu cơ trong Pin Li-Ion được dựa trên dung môi rất dễ cháy. Vì vậy Pin Li-Ion dễ bị phát nổ khi chúng ta sử dụng sai cách.
- Ngoài ra thì pin Li-Ion chỉ có thể sản xuất được dưới dạng hình chữ nhật nên nó có thể sẽ không phù hợp với một số thiết bị có hình dạng đặc biệt.
- Có trọng lượng lớn hơn nếu so với pin Polymer.
- Pin Li-Ion cũng bị xuống cấp ngay cả khi bạn không sử dụng.
Theo như lý thuyết nạp xả của một cục pin vừa phân tích ở trên thì chắc chắn một điều chúng ta sẽ có một cục pin sử dụng suốt một thời gian dài mà không hư.
Tuy nhiên thực tế các nhà khoa học đã phát hiện ra một điều cực kỳ quan trọng, việc di chuyển các điện tích giữa 2 cực và dung lượng pin được tích tụ một phần là do vật liệu làm 2 cực của viên pin. Khi các ion Li+ di chuyển liên tục trong viên pin sẽ dần bị kẹt lại trong các tinh thể nhỏ và lâu dần bị tắc ngẽn ảnh hưởng đến quá trình di chuyển của các ion khác. Chính điều này làm pin của chúng ta trong quá trình nạp xả bị chai dần theo thời gian.
4. Cách sạc Pin Li - ion đúng cách
Trước đây, khi mua điện thoại, nhân viên tư vấn luôn nhắc bạn nên sạc điện thoại 8 tiếng trong ba lần đầu tiên để giúp pin Li - ion đầy, như thế sau 3 lần 8 tiếng thì bạn sẽ sạc bình thường.
Nhưng từ năm 2016, các dòng thiết bị sử dụng Pin li ion, thì nhà sản xuất không còn nhấn mạnh vào vấn đề sạc 8 tiếng nữa, có thể việc phải canh chờ cho máy sạc đầy pin này quá phiền phức.
Cách sạc pin Li ion đúng cách:
- Bạn chỉ nên dùng bộ phụ kiện sạc chính hãng đi kèm theo máy khi mới mua.
- Khi mua một thiết bị mới về bạn nên dùng hết lượng pin còn lại trên máy, khi pin báo yếu bạn sẽ kết nối với bộ sạc, không nên để thiết bị sụp nguồn ở lần sạc đầu tiên này.
- Không nên sạc qua đêm, tuỳ vào dung lượng pin thực tế trên từng thiết bị mà bạn sẽ sắp xếp để sạc đầy pin rồi ngắt sạc.
- Sau khi thiết bị đầy pin, bạn nên giữ sạc trong 5 – 10 phút rồi hẳn ngắt sạc.
- Khi mới mua thiết bị về, bạn nên sạc 5 lần đầu khi điện thoại báo pin yếu và sạc đến khi đầy 100% là được.


.jpg)
.jpg)




.jpg)
.jpg)










