1. Định nghĩa, phân loại
a. Định nghĩa
Phenol là những hợp chất hữu cơ có một hay nhiều nhóm hidroxi đính trực tiếp vào nguyên tử cacbon của vòng thơm. Nhóm -OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen được gọi là -OH phenol. Chất tiêu biểu là C6H5OH có tên là phenol, phân tử gồm một nhóm -OH liên kết trực tiếp với gốc phenyl.
b. Phân loại
Dựa vào số nhóm -OH trong phân tử, các phenol được phân loại thành
- Phenol đơn chức: Phân tử có 1 nhóm -OH phenol
Ví dụ:
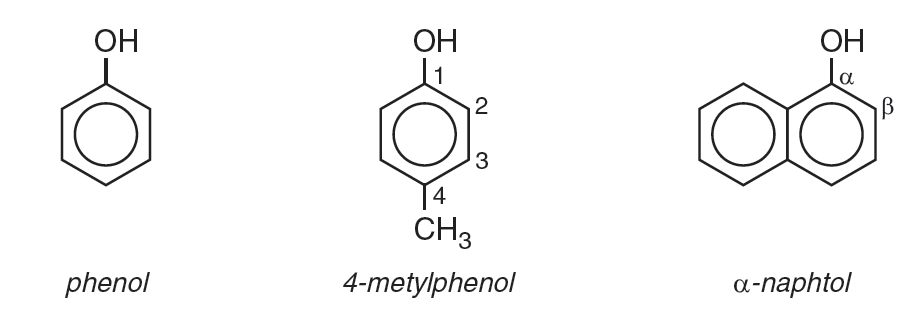
- Phenol đa chức: Phân tử có hai hay nhiều nhóm -OH phenol.
 2. Cấu tạo
2. Cấu tạo
Pheol có công thức phân tử là C6H6O và có công thức cấu tạo: C6H5OH hoặc 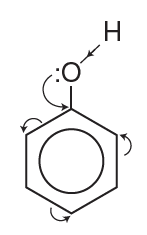
3. Tính chất vật lý
Ở điều kiện thường, phenol là chất rắn, không màu, nóng chảy ở 430C. Để lâu phenol chuyển thành màu hồng do bị oxi hóa chậm trong không khí.
Phenol rất độc, khi dây vào tay nó gây bỏng da do đó khi sử dụng phenol phải hết sức cẩn thận.
Phenol ít tan trong nước lạnh, nhưng tan nhiều trong nước nóng và trong etanol.
4. Tính chất hóa học
Do trong phân tử phenol có sự liên hợp n → π làm tăng sự phân cực của nhóm hidroxi, đồng thời làm giảm sự phân cực của liên kết C-O và tăng mật độ electron trong vòng benzen đặc biệt tại các vị trí ortho và para. Với nguyên nhân trên những phản ứng làm đứt dị li liên kết O-H xảy ra dễ dàng, trái lại phản ứng đứt liên kết C-O lại khó khăn do liên C-O bị ngắn lại vì có sự liên hợp.
a.Tính axit
Phenol có tính axit mạnh hơn so với ancol, nhưng lại yếu hơn so với axit cacboxylic
Sỡ dĩ tính axit của phenol lớn hơn ancol là do ảnh hưởng của vòng benzen nên độ phân cực của nhóm OH trong phenol lớn hơn trong ancol. Mặt khác, tính ổn định của anion phenolat bền hơn so với anion ancolat.
Các nhóm thế có hiệu ứng -I và -C ở trong nhân sẽ làm tăng tính axit của phenol, còn các nhóm có hiệu ứng +I; +C sẽ làm giảm tính axit khác nhau.
Vì vậy, khác với rượu, phenol còn có thể tác dụng với bazơ mạnh tạo muối phenolate:
Tuy nhiên, tính axit của phenol rất yếu Ka=10-10 , yếu hơn axit cacbonic nên không làm đổi màu quỳ tím. Vì vậy, muối phenolat bị axit cacbonic tác dụng tạo lại phenol:
Phản ứng này được dùng để tái tạo phenol trong công nghiệp.
b. Tính chất như rượu
Phenol có thể tác dụng được với Na như rượu nhưng khác với rượu, muối phenolat không bị nước phân hủy:
(C6H5ONa + H2O ---> (Không phản ứng).
Phenol cũng tạo được este như rượu nhưng khác với rượu có thể tác dụng trực tiếp với axit, phenol chỉ có thể tác dụng với clorua axit hoặc anhidric axit mới tạo được este:
C6H5OH + CH3COCl ---> CH3COOC6H5 + HCl
C6H5OH + (CH3CO)2O ---> CH3COOC6H5 + CH3COOH
Điều này được giải thích do 2 nguyên nhân:
Mật độ điện tích âm của O nhóm -OH vì có hệ liên hợp trong phân tử nên giảm hơn so với O nhóm -OH của rượu thông thường, dẫn đến phenol khó tấn công vào phân tử axit tạo este hơn.
Phenol có vòng thơm nên gây hiệu ứng không gian cản trở.
c. Tính chất của nhân thơm (Phản ứng thế H ở vòng Benzen)
Phenol phản ứng với dung dịch brom tạo kết tủa trắng, nếu Br2 dư cũng tạo kết tủa tan
Phenol phản ứng với HNO3 tạo kết tủa tan
Phenol tham gia phản ứng thế brom dễ hơn benzen do có nhóm OH đẩy e làm tăng mật độ electron trong vòng benzen
5. Ứng dụng
Phenol được dùng trong nhiều lĩnh vực khác nhau:
Công nghiệp chất dẻo: phenol là nguyên liệu để điều chế nhựa phenol formaldehyde.
Công nghiệp tơ hóa học: Từ phenol tổng hợp ra tơ polyamide.
Nông dược: Từ phenol điều chế được chất diệt cỏ dại và kích thích tố thực vật 2,4 - D (là muối natri của axit 2,4 điclophenoxiaxetic).
Phenol cũng là nguyên liệu để điều chế một số phẩm nhuộm, thuốc nổ (axit picric).
Do có tính diệt khuẩn nên phenol được dùng để trực tiếp làm chất sát trùng, tẩy uế, hoặc để điều chế các chất diệt nấm mốc (ortho - và para - nitrophenol…)




.jpg)
.jpg)




.jpg)
.jpg)










