Liên kết kim loại
a. Khái niệm : là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các e tự do.
.png)
b. Điều kiện liên kết : Xảy ra ở hầu hết các kim loại.
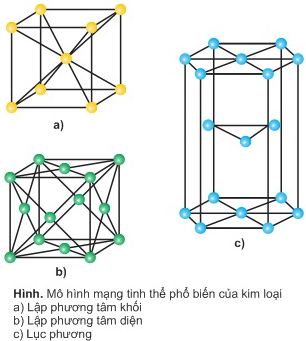
c. Mạng tinh thể kim loại
+ Lập phương tâm khối : Nguyên tử kim loại, ion kim loại nằm ở tâm và các đỉnh của khối lập phương.
Ví dụ : Li,Na,K,Rb,V,Cr,Fe,Nb,Mo,Ta,W,Eu
+ Lập phương tâm diện: Nguyên tử kim loại, ion kim loại nằm ở tâm các mặt và các đỉnh của khối lập phương.
Ví dụ : Ca,Sr,Al,Ni,Cu,Ag,Au...
+ Lục phương: Nguyên tử kim loại, ion kim loại nằm ở tâm các mặt của hình lục giác đứng và các đỉnh của hình lục giác.
Ví dụ : Be,Mg,Zn,Cd,Co,La...
d. Tính chất của tinh thể kim loại :
Mạng tinh thể kim loại có các e tự do di chuyển được trong mạng tinh thể nên kim loại có một số tính chất cơ bản : Ánh kim, dẫn điện tốt, dẫn nhiệt tốt và có tính dẻo.

.jpg)
.jpg)




.jpg)
.jpg)










