1. Bản chất liên kết hidro
Nguyên tử hidro chỉ có 1 electron, khi tham gia liên kết đôi electron dùng chung lệch hẳn về phía nguyên tử của nguyên tố có độ âm điện lớn khiến nó trở nên gần như một "proton trần". Vì thế nó có khả năng tiến lại rất gần vỏ electron của một nguyên tử âm điện khác do lực hút tĩnh điện giữa chúng. Khi đó một liên kết yếu được hình thành, người ta gọi đó là liên kết hidro. Những ion như Li+; Na+... không thể hình thành liên kết kiểu tương tự như thế được bởi vì vỏ electron của nguyên tử đã ngăn cản chúng lại quá gần vỏ electron của các nguyên tử khác.
Liên kết hidro là một loại liên kết yếu được hình thành khi nguyên tử hidro đã tham gia liên kết cộng hóa trị với nguyên tử của một nguyên tố âm điện mạnh lại tương tác với một nguyên tử âm điện khác có cặp electron chưa liên kết (chưa chia).
Biểu diễn:
AX-H...YB
X,Y thường là F, O, N (ở Y có ít nhất 1 cặp electron chưa chia). A và B là phần còn lại của phân tử.
Liên kết hidro không phù hợp với hóa trị của hidro. Vì vậy, trong nhiều năm người ta cho rằng nó có bản chất tĩnh điện. Nhưng khi tính toán kĩ càng, người ta nhận thấy nó cũng có bản chất cơ lượng tử như các liên kết khác giữa các phân tử. Phân tích năng lượng cho thấy, liên kết hidro cũng có đặc trưng cộng hóa trị rõ ràng. Đó là liên kết 3 tâm (X, H, Y) được đảm bảo bởi hai cặp electron, một cặp electron ở liên kết X -H, một cặp electron chưa chia ở Y. Khoảng cách giữa hai nguyên tử X và Y trong liên kết hidro X -H...Y nhỏ hơn nhiều tổng bán kính Van de Van của chúng, điều đó cho thấy hai cặp electron đó không phải là riêng rẽ, không đẩy nhau mà đã có tương tác trao đổi, chúng không định vị mà hợp thành obitan chung cho cả 3 nguyên tử liên kết. Tuy nhiên, nguyên tử H vẫn liên kết bất đối xứng với X và Y, một bên liên kết mạnh, một bên liên kết yếu mặc dù sự khác nhau là không lớn lắm và thay đổi tùy từng trường hợp cụ thể.
2. Độ bền của liên kết hidro
Độ bền của liên kết hidro phụ thuộc nhiều yếu tố. Liên kết sẽ mạnh nhất khi 3 nguyên tử X, H, Y nằm thẳng hàng. Độ âm điện của X và Y càng lớn thì liên kết hidro càng mạnh vì thế liên kết hidro yếu dần theo chiều F>O>N>Cl, Br, S>P. Ngoài ra liên kết hidro còn chịu ảnh hưởng bởi phần còn lại của phân tử.
3. Liên kết hidro liên phân tử và nội phân tử
Trong sự tạo thành liên kết hidro, AX-H...YB, hợp phần AX-H đưa nguyên tử hidro vào liên kết nên được gọi là hợp phần cho hoặc chất cho, hợp YB đưa cặp electron chưa chia sẽ để tiếp nhận nguyên tử H phân cực nên được gọi là hợp phần nhận hoặc chất nhận. Sự phân chia như vậy cho thấy có sự tương đồng với tương tác axit - base, và thực ra sự tạo thành liên kết hidro thường là khởi đầu cho phản ứng axit - base. Thí dụ, ở vế trái trong cân bằng sau CH3COOH là chất cho, NH3 là chất nhận còn ở vế phải thì NH4+ là chất cho, CH3COO- là chất nhận.

Liên kết hidro mà hợp phần cho và hợp phần nhận ở hai phân tử khác nhau hoặc giống nhau được gọi là liên kết hidro liên phân tử.
Thí dụ

Liên kết hidro mà hợp phần cho và hợp phần nhận đều ở cùng một phân tử gọi là liên kết hidro nội phân tử.
Thí dụ
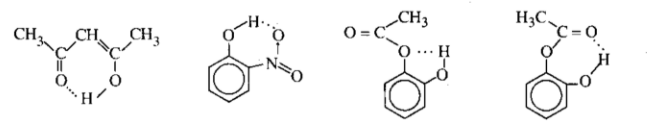
Để tạo được liên kết hdiro nội phân tử, hợp phần cho và hợp phần nhận phải ở hai vị trí sao cho H có thể tiếp cận với obitan chứa đôi electron chưa liên kết của Y, khi đó thường tạo ra vòng 5, 6 hoặc đôi khi 7 cạnh. Liên kết hidro nội phân tử thường kém bền hơn liên kết hidro liên phân tử. Vì vậy, nếu hai hợp phần cho và nhận trong một phân tử đã tạo thành liên kết hidro nội phân tử thì chúng không tham gia vào liên kết hidro liên phân tử nữa.
4. Ảnh hưởng của liên kết hidro đến tính chất vật lý
Nếu phân tử khối, momen lưỡng cực, hình dạng phân tử không khác nhau nhiều thì chất nào tạo được liên kết hidro liên phân tử, chất đó có tnc và ts cao hơn so với chất không tạo được liên kết hidro liên phân tử.
Những chất tạo nên liên kết hdiro bền với nhau thì tan tốt vào nhau.
Liên kết hidro nội phân tử ảnh hưởng đến tnc, ts và độ tan không giống như liên kết hidro liên phân tử. Trong những chất đồng phân hoặc những chất có cấu tạo tương tụ nhau, chất nào tạo nên liên kết hdiro nội phân tử thì có tnc, ts thấp hơn, độ tan trong dung môi phân cực thấp hơn, độ tan trong dung môi không phân cực cao hơn với chất tạo liên kết hidro liên phân tử.
Thí dụ:
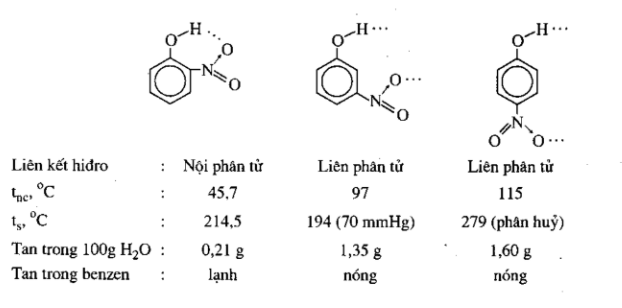

.jpg)
.jpg)




.jpg)
.jpg)










