1. Tính chất vật lí
Do có cấu hình electron bền, khí hiềm gồm những phân tử đơn nguyên tử. Điều đó đã được xác định qua tỉ số của các nhiệt dung phân tử ở áp suất không đổi và thể tích không đổi Cp/Cv tỉ số này bằng 1,6666 đối với các khí đơn nguyên tử.
Tất cả các khí hiếm đều không có màu và mùi. Chúng rất khó hóa lỏng và hóa rắn vì giữa các phân tử (nguyên tử) khí hiếm chỉ có lực Van de Van rất yếu.
Một số tính chất vật lí của khí hiếm
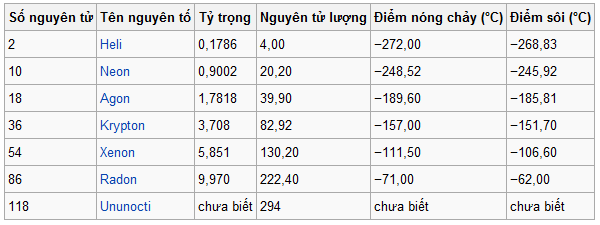
Một số tính chất vật lí của các nguyên tố khí hiếm
Từ heli đến radon, khối lượng phân tử và khả năng bị cực hóa của phân tử tăng lên làm cho lực Van de van tăng lên, nên nhiệt độ nóng chảy và nhiệt độ sôi của các khí hiếm tăng lên. Trong các khí hiếm, heli có nhiệt độ sôi thấp nhất nên heli lỏng thường được dùng để tạo những nhiệt độ rất thấp trong các công trình nghiên cứu lí hóa học. Khác với các khí hiếm khác, heli lỏng có hai dạng: heli I tồn tại ở trên nhiệt độ 2172K, có những đặc tính bất thường không có ở bất cứ chất lỏng nào khác. Heli II có độ dẫn nhiệt rất lớn, gấp 800 lần độ dẫn nhiệt của đồng ở nhiệt độ thường, có độ nhớt rất bé, gần bằng 1/1000 độ nhớt của khí hidro và có thể tạo nên những màng mỏng có bề dày chỉ vài trăm nguyên tử, chảy được qua các ống rất nhỏ hay các khe rất hẹp mà không cần phải bơm vì không có ma sát gì cả. Một số nhà nghiên cứu coi heli II như là trạng thái thứ tư của chất. Hiện nay người ta cũng chưa giải thích được tính chất bất thường đó của heli II.
Heli rắn có mạng lưới lục phương giống như hidro rắn còn các nguyên tố khí hiếm khác ở trạng thái rắn có mạng lưới lập phương tâm diện.
Các khí hiếm tương đối dễ tan trong nước và độ tan tăng lên dần từ heli đến radon. Trong các dung môi hữu cơ như rượu, benzen, độ tan của các khí hiếm còn lớn hơn. Các khí hiếm dễ dàng bị than hấp phụ ở nhiệt độ thấp và khả năng bị hấp phụ đó tăng lên theo chiều tăng của khối lượng phân tử. Khi đun nóng dần, các khí hiếm đã được hấp phụ lần lượt thoát ra theo thứ tự ngược lại. Dựa vào tính chất này người ta dùng than hoạt tính để tách riêng các khí hiếm ra khỏi nhau.
Ở trong ống phóng điện, khí hiếm tạo ra các màu đặc trưng: vàng (heli), đỏ (neon), lam nhạt hơi đỏ (Agon), tím (kripton) và lam (xenon). Trong thực tế neon được dùng để nạp vào bóng đèn quảng cáo và bóng đèn báo hiệu ở sân bay và biển.
2. Tính chất hóa học
Trong một thời gian dài trước đây người ta coi các khí hiếm là những nguyên tố không có khả năng tạo thành những hợp chất hóa học bền, nghĩa là trơ và chúng được gọi là khí trơ hoặc khí quý. Những hidrat của khí hiếm có thành phần gần với X.6H2O (X = Ne, Ar, Kr và Xe) được tạo nên ở nhiệt độ thấp và dưới áp suất cao không phải là hợp chất hóa học thực sự mà là một loại hợp chất bao giống như hidrat của các halogen. Những hidrat của khí hiếm rất kém bền và độ bền tăng lên từ Ne và Xe. Tuy nhiên đến gần đây quan niệm về tính trơ tuyệt đối của các nguyên tố khí hiếm hầu như không còn nữa. Xuất phát từ chỗ năng lượng ion hóa thì các nguyên tố khí hiếm nặng như Kr, Xe và Rn có nhiều hơn khả năng tạo thành hợp chất. Dựa vào độ âm điện thì những nguyên tố có khả năng tạo thành hợp chất với khí hiếm phải là flo, oxi và clo. Radom là nguyên tố phóng xạ, các hợp chất của nó chưa được nghiên cứu nhiều. Thực tế những hợp chất của khí hiếm đã được biết chủ yếu là hợp chất của xenon với flo và oxi. Kripton tạo nên một số hợp chất ít hơn và kém bền hơn. Đối với heli là một trong những nguyên tố hiếm nhất, gần đây có những thông báo cho biết có những hợp chất như HgHe10.WHe2 được tạo nên ở trong ống phóng điện.


.jpg)
.jpg)




.jpg)
.jpg)










