1. Khái niệm
Khi thay nhóm OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm OR’ thì được este. Este là dẫn xuất của axit cacboxylic.
Este đơn giản có công thức như sau:
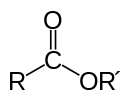
Trong đó R là gốc hidrocacbon hay H; R’ là gốc hidrocacbon
Este no đơn chức mạch hở : CnH2nO2 ( với n ≥ 2)
2. Danh pháp
Tên este gồm: Tên gốc R’( gốc ankyl ) + tên gốc axit RCOO (đuôi at)
Vd: CH3COOC2H5: Etyl axetat; HCOOCH(CH3)2 : isopropylfomat,
CH2=CH-COOCH3: Metyl acrylat;
CH3COOCH2C6H5 : benzylaxetat , CH3COOCH= CH2 vinylaxetat ….
3. Tính chất vật lý
Giữa các phân tử este không có liên kế hidro vì thế este có nhiệt độ sôi thấp hơn so với axit và ancol có cùng số nguyên tử C.
Các este thường là những chất lỏng, nhẹ hơn nước, rất ít tan trong nước, có khả năng hòa tan được nhiều chất hữu cơ khác nhau. Những este có khối lượng phân tử rất lớn có thể ở trạng thái rắn (như mỡ động vật, sáp ong..). Các este thường có mùi thơm dễ chịu, chẳng hạn isoamyl axetat có mùi chuối chín, etyl butirat có mùi dứa, etyl isovalerat có mùi táo,..
.jpg)
4. Tính chất hóa học
a. Phản ứng ở nhóm chức
- Phản ứng thủy phân
+ Thủy phân trong môi trường axít (phản ứng thuận nghịch):
RCOOR′ + H2O (H+) ↔ RCOOH + R′OH
+ Thuỷ phân trong môi trường kiềm hay còn gọi là phản ứng xà phòng hóa.
RCOOR’ + NaOH → RCOONa + R’OH
- Phản ứng khử
Este bị khử bởi liti nhôm hidrua (LiAlH4) khi đó nhóm RCO- (nhóm axyl) trở thành ancol bậc I
RCOOR' → RCH2OH + R'OH
b. Phản ứng ở gốc hydrocacbon
Este có thể tham gia phản ứng thế, cộng, tách, trùng hợp,..
- Phản ứng cộng vào gốc không no: Gốc hidrocacbon không no ở este có phản ứng cộng với H2; Br2; Cl2... giống như hidrocacbon không no.
Ví dụ: Phản ứng chuyển hoá dầu (chất béo lỏng) thành mỡ (chất béo rắn), xúc tác Ni to
(C17H33COO)3C3H5 + 3H2 → (C17H35COO)3C3H5
(Triolein) (Tristearin)
- Phản ứng trùng hợp: Một số este đơn giản có liên kết đôi C=C tham gia phản ứng trùng hợp giống như anken.
Ví dụ: Phản ứng trùng hợp vinyl axetat thành poli(vinyl axetat)
CH3-COO-CH=CH2 → [-(CH3COO)-CH-CH2-]n
5. Điều chế
Có thể điều chế este bằng phản ứng giữa rượu đơn chức hoặc đa chức với axit hữu cơ đơn chức hoặc đa chức. Phản ứng này được gọi là phản ứng este hóa. Ngoài ra còn có thể dùng axit tác dụng với ankin hoặc cũng có thể cho phenol cộng với anhiđrit axit.
Công thức tổng quát phản ứng este hoá giữa rượu và axit cacboxilit (Phản ứng thuận nghịch, điều kiện: H2SO4 đặc, to)
R(COOH)x + xR'OH <=> R(COOR')x + xH2O
yR(COOH)x + xR'(OH)y <=> Ry(COO)xyR'x + xyH2O
xRCOOH + R'(OH)x <=> R'(OOCR)x + xH2O
Ví dụ: C2H5OH + CH3COOH <=> CH3COOC2H5 + H2O
6. Ứng dụng
Do có khả năng hòa tan tốt các chất hữu cơ, kể cả hợp chất cao phân tử nên este được sử dụng làm dung môi (ví dụ: butyl và amyl axetat được dùng để pha sơn tổng hợp).
Poli (metyl acrylat) và poli (metyl metacrylat) được dùng làm thủy tinh hữu cơ.
Poli (vinyl axetat) dùng làm chất dẻo, hoặc thủy phân thành poli (vinyl ancol) dùng làm keo dán. Một só este của axit phtalic được dùng làm chất hóa dẻo, làm dược phẩm.
Một số este có mùi thơm của hoa quả được dùng trong công nghiệp thực phẩm (kẹo bánh, nước giải khát) và mĩ phẩm (Xà phòng, nước hoa...)

.jpg)
.jpg)




.jpg)
.jpg)










