1. Vị trí và cấu tạo
Đồng là nguyên tố kim loại chuyển tiếp, thuộc nhóm IB, chu kì 4, ô thứ 29
Cấu hình electron: [Ar]3d104s1.
So với kim loại nhóm IA, đồng có bán kính nguyên tử nhỏ hơn, ion đồng có điện tích lớn hơn. Kim loại đồng có cấu tạo kiểu mạng tinh thể lập phương tâm diện là tinh thể đặc chắc, do vậy liên kết trong đơn chất đồng bền vững hơn.
2. Tính chất vật lí
Đồng là kim loại màu đỏ, dẻo, dễ kéo sợi và dát mỏng (có thể dát mỏng đến 0,0025 mm, mỏng hơn giấy viết 5 -6 lần). Đồng có độ dẫn điện và dẫn nhiệt rất cao (Chỉ kém bạc). Độ dẫn điện của đồng giảm nhanh nếu có lẫn tạp chất. Do vậy dẫn điện là đồng có độ tinh khiết tới 99,99%. Khối lượng riêng của đồng là 8,98 g/cm3, nhiệt độ nóng chảy là 108,3oC.
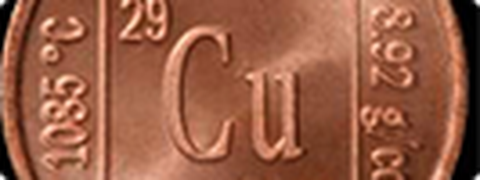
3. Tính chất hóa học
Đồng là kim loại kém hoạt động, có tính khử yếu. Tính chất này được chứng minh qua những phản ứng hóa học sau:
a. Tác dụng với phi kim
Khi đốt nóng, Cu không cháy trong khí oxi mà tạo thành màng CuO màu đen bảo vệ Cu không bị oxi hóa tiếp tục
2Cu + O2 2CuO
Nếu tiếp tục đốt nóng Cu ở nhiệt độ cao hơn 800-1000oC, một phần CuO ở lớp bên rong oxi hóa Cu thành Cu2O màu đỏ
CuO + Cu Cu2O
Trong không khí khô, Cu không bị oxi hóa vì có màng oxit bảo vệ. Nhưng trong không khí ẩm, với sự có mặt của CO2, đồng bị bao phủ bởi màng cacbonat base màu xanh CuCO3.Cu(OH)2.
Đồng có thể tác dụng với Cl2, Br2, S ở nhiệt độ thường hoặc đun nóng
Cu + Cl2 CuCl2
Cu + S CuS
b. Tác dụng với axit
Đồng không tác dụng với dung dịch HCl, H2SO4 loãng. Tuy vậy, với sự có mặt của oxi trong không khí, Cu bị oxi hóa thành muối Cu(II).
Cu + HCl + O2 2CuCl2 + 2H2O
Đồng bị oxi hóa dễ dàng trong H2SO4 đặc nóng và HNO3.
Cu + 2H2SO4 (đặc) CuSO4 + SO2 +2H2O
4. Ứng dụng
Đồng là vật liệu dễ dát mỏng, dễ uốn, có khả năng dẫn điện và dẫn nhiệt tốt, vì vậy nó được sử dụng một cách rộng rãi trong sản xuất các sản phẩm: dây điện; que hàn đồng; tay nắm và các đồ vật khác trong xây dựng nhà cửa; đúc tượng; cuộn từ của nam châm điện; động cơ, đặc biệt là các động cơ điện; động cơ hơi nước của Watt; rơ le điện, dây dẫn điện giữa các bảng mạch và các chuyển mạch điện...
Đồ đồng là những sản phẩm làm từ nguyên liệu bằng đồng ví dụ như tượng đồng, tranh đồng, trống đồng... Từ lâu đồ đồng đã được dùng như là những dụng cụ, đồ vật trang trí trong nhà không thể thiếu của người Việt Nam chúng ta. Nhất là trong tín ngưỡng, văn hóa dân gian. Từ lâu người Việt đã dùng đồng để làm đồ thờ cúng trong ban thờ gia tiên như: hoành phi câu đối bằng đồng, bộ đồ thờ cúng bằng đồng, đỉnh đồng, lư đồng, hạc đồng...
Đồ đồng mỹ nghệ là những sản phẩm mỹ nghệ làm từ đồng ví dụ như: tượng đồng, tranh đồng, trống đồng... Những sản phẩm mỹ nghệ làm từ đồng luôn được ưa chuộng và rất hay được sử dụng trong nhà nhất là tranh đồng, tượng đồng
Đồ đồng phong thủy là những vật phẩm, linh vật, tượng... làm từ đồng. Đồ đồng phong thủy dùng để trấn trạch, hoặc dùng để thỉnh cầu một nguyện vọng nào đó: hóa cát thành hung, giải thoát tai ương, mong muốn những điều tốt đẹp nhất đến với mình và gia đình mình


.jpg)
.jpg)




.jpg)
.jpg)










