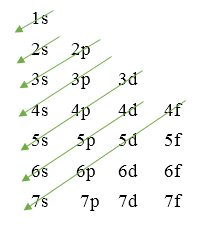
I. THỨ TỰ CÁC MỨC NĂNG LƯỢNG TRONG NGUYÊN TỬ
Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao: 1s 2s 2p
3s 3p 4s 3d 4p 5s…
II. CẤU HÌNH ELECTRON NGUYÊN TỬ
1. Cấu hình electron nguyên tử:
- Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
- Quy ước cách viết cấu hình electron nguyên tử:
+ Số thứ tự lớp electron bằng các chữ số: 1, 2, 3
+ Phân lớp được kí hiệu bằng chữ cái thường: s, p, d, f
+ Số electron trong phân lớp được ghi bằng chỉ số ở phía trên bên phải kí hiệu của phân lớp: s2, p6, d10…
- Cách viết cấu hình electron nguyên tử:
+ Xác định số electron của nguyên tử.
+ Các electron được phân bố theo thứ tự tăng dần các mức năng lượng AO, tuân theo các nguyên lí Pau-li, nguyên lí vững bền và quy tắc Hun.
+ Viết cấu hình electron theo thứ tự các phân lớp trong 1 lớp và theo thứ tự của các lớp electron.
+ Lưu ý: các electron được phân bố vào các AO theo phân mức năng lượng tăng dần và có sự chèn mức năng lượng. Tuy nhiên, khi viết cấu hình electron, các phân mức năng lượng cần được sắp xếp lại theo từng lớp.
Ví dụ: Nguyên tử Fe có Z= 26.
+ Có 26e
+ Các e được phân bố như sau: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Có sự chèn mức năng lượng 4s < 3d
+ Sắp xếp lại các phân lớp theo từng lớp, ta được cấu hình e: 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Hoặc viết gọn: [Ar] 3d6 4s2 ( [Ar] là cấu hình electron nguyên tử của nguyên tố argon, là khí hiếm gần nhất đứng trước Fe )
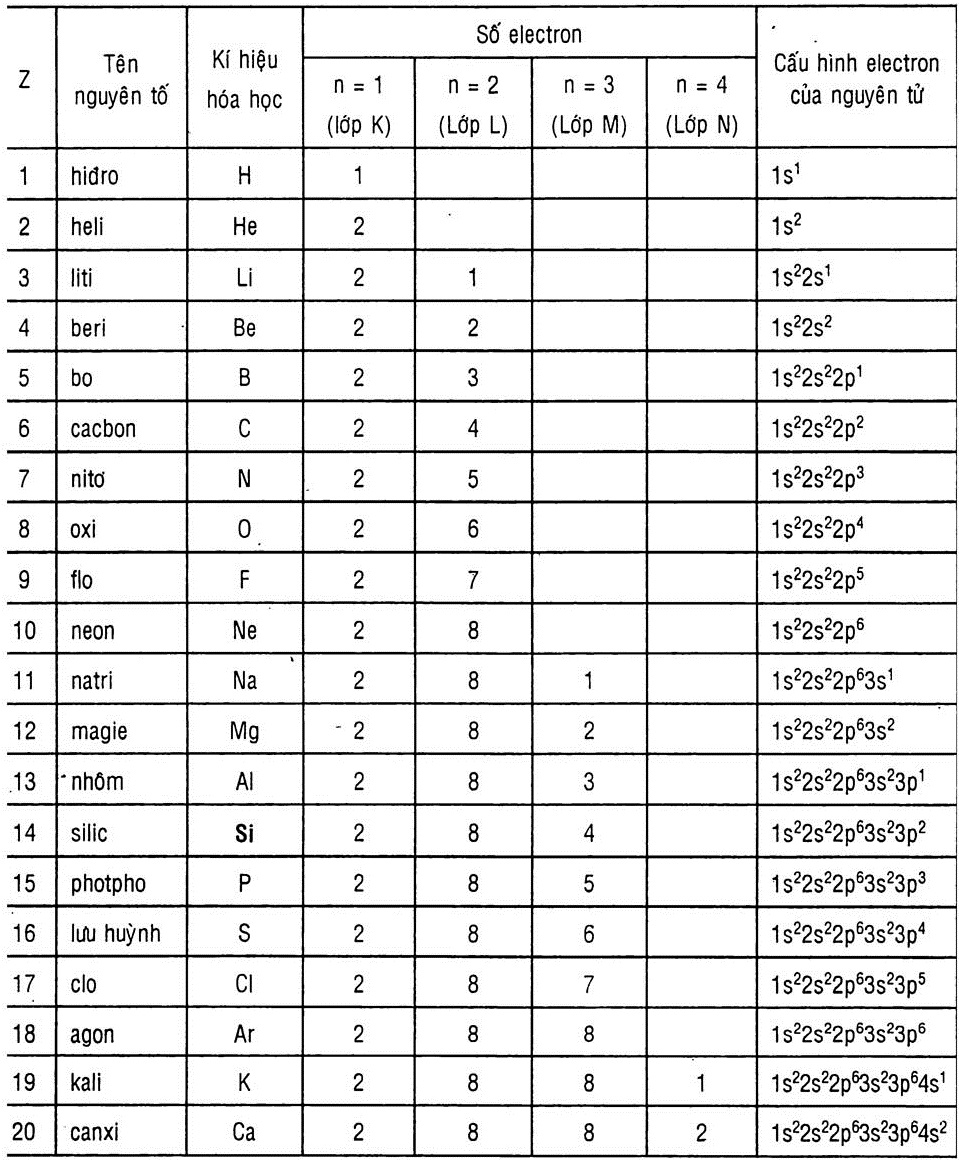
2. Cấu hình electron của 20 nguyên tố đầu tiên
3. Đặc điểm của lớp electron ngoài cùng:
- Các electron ở lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố:
+ Số electron tối đa ở lớp ngoài cùng của nguyên tử mỗi nguyên tố là 8 electron. Các nguyên tử có 8e lớp ngoài cùng đều rất bền vững, chúng hầu như không tham gia vào các phản ứng hóa học. Đó là các nguyên tử khí hiếm ( trừ He có 2e lớp ngoài cùng ).
+ Các nguyên tử có 1, 2, 3e ở lớp ngoài cùng là các nguyên tử kim loại, trừ H, He và B.
+ Các nguyên tử có 5, 6, 7e ở lớp ngoài cùng thường là các nguyên tố phi kim.
+ Các nguyên tử có 4e ở lớp ngoài cùng có thể là nguyên tử kim loại hoặc phi kim

.jpg)
.jpg)




.jpg)
.jpg)










