I. ĐỊNH NGHĨA, PHÂN LOẠI
1. Định nghĩa
Ancol là hợp chất hữu cơ mà trong phân tử có nhóm hiđroxyl (-OH) liên kết trực tiếp với nguyên tử cacbon no của gốc hiđrocacbon.
2. Phân loại
a) Ancol no, đơn chức, mạch hở
Phân tử có một nhóm -OH liên kết với gốc ankyl: 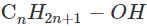
b) Ancol không no, đơn chức, mạch hở
Phân tử có một nhóm -OH liên kết với nguyên tử cacbon no của gốc hiđrocacbon không no.
c) Ancol thơm, đơn chức
Phân tử có nhóm -OH liên kết với nguyên tử cacbon no thuộc mạch nhánh của vòng benzen.
d) Ancol vòng no, đơn chức
Phân tử có một nhóm -OH liên kết với nguyên tử cacbon no thuộc gốc hiđrocacbon vòng no.
e) Ancol đa chức
Phân tử có hai hay nhiều nhóm -OH ancol.
II. ĐỒNG PHÂN, DANH PHÁP
1. Đồng phân
Có 2 loại:
Đồng phân về vị trí nhóm chức
Đồng phân về mạch cacbon
VD: Viết các đồng phân ancol có công thức: C4H9OH
.png)
2. Danh pháp
a) Tên thông thường (gốc - chức)
Ví dụ:
CH3 - OH (Ancol metylic)
CH3 - CH2 - OH (ancol etilic)
CH3 - CH2 - CH2 - OH (ancol propylic)
Nguyên tắc: Ancol + tên gốc ankyl + ic
b) Tên thay thế
Tên hiđrocacbon tương ứng với mạch chính + số chỉ vị trí nhóm OH + ol
III. TÍNH CHẤT VẬT LÝ
Ancol là chất lỏng hoặc rắn, tan được trong nước
Độ tan tỉ lệ nghịch với phân tử khối
Nhiệt độ sôi tỉ lệ thuận với phân tử khối.
Liên kết hiđro: Nguyên tử H mang một phần điện tích dương δ+δ+ của nhóm -OH này khi ở gần nguyên tử O mang một phần điện tích δ−δ− của nhóm -OH kia thì tạo thành một liên kết yếu gọi là liên kết hiđro, biểu diễn bằng dấu...
.png)
a) Giữa các phân tử ancol với nhau
b) Giữa các phân tử ancol với các phân tử nước
Ảnh hưởng của liên kết hiđro đến tính chất vật lí: liên kết hidro làm cho ancol có nhiệt độ sôi cao hơn, tan nhiều trong nước hơn.
IV. TÍNH CHẤT HÓA HỌC
Trong phân tử, liên kết C 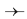 OH đặc biệt liên kết O
OH đặc biệt liên kết O ![]() H phân cực mạnh nên nhóm -OH, nhất là nguyên tử H dễ bị thay thế hoặc tách ra trong phản ứng hóa học.
H phân cực mạnh nên nhóm -OH, nhất là nguyên tử H dễ bị thay thế hoặc tách ra trong phản ứng hóa học.
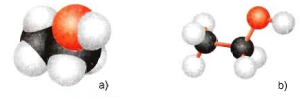
Mô hình phân tử etanol
a) Dạng đặc b) Dạng rỗng
1. Phản ứng thế H của nhóm -OH
a. Tính chất chung của ancol
Tác dụng với kim loại kiềm:
Phương trình tổng quát: R-OH+ Na(K)→R-ONa + 1/2H2
Natri phản ứng với etanol tạo khí hidro: 2C2H5-OH +2Na →2C2H5-ONa + H2
Đốt khí thoát ra ở đầu vuốt nhọn, hidro cháy với ngọn lửa xanh mờ: 2H2 + O2 .png) H2O
H2O
b. Tính chất đặc trưng của glixerol
Phản ứng này cần sử dụng Cu(OH)2 mới sinh, do đó khi cần tiến hành thí nghiệm người ta mới điều chế Cu(OH)2
Phương trình phản ứng:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Hòa tan Cu(OH)2 tạo dd màu xanh lam.
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu +2H2O.
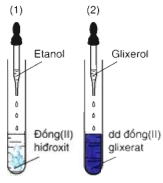
Glixerol hòa tan Đồng (II) hidroxit thành dung dịch màu xanh lam (2)
Etanol không có tính chất này (1)
⇒ Phản ứng này được dùng để phân biệt ancol đơn chức với ancol đa chức có các nhóm -OH cạnh nhau trong phân tử.
2. Phản ứng thế nhóm -OH
a. Phản ứng với axit vô cơ
C2H5-OH + HBr ![]() C2H5-Br + H2O
C2H5-Br + H2O
b. Phản ứng với ancol
C2H5-OH + H-OC2H5 ![]() C2H5-O-C2H5 + H2O
C2H5-O-C2H5 + H2O
3. Phản ứng tách nước
CH3-CH2-OH 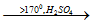 CH2=CH2 + H2O
CH2=CH2 + H2O
⇒ Tính chất này được ứng dụng để điều chế anken từ các ankanol
4. Phản ứng oxi hóa
a. Oxi hóa không hoàn toàn
Ancol bậc 1→ andehit (-CH→O)
Ancol bậc 2: → xetôn (>C→O)
Trong điều kiện như trên các ancol bậc 3 không bị oxi hóa.
b. Oxi hóa hoàn toàn
Cháy tỏa nhiều nhiệt
Phương trình tổng quát: CnH2n+1-OH + 3n/2O2 ![]() nCO2 + (n+1)H2O
nCO2 + (n+1)H2O
V. ĐIỀU CHẾ
1. Phương pháp tổng hợp
a. Etanol tổng hợp từ etylen: C2H4 + H2O![]() C2H5-OH
C2H5-OH
b. Glixerol tổng hợp từ propilen
.png)
2. Phương pháp sinh hóa
Từ các nông sản chứa nhiều tinh bột, đường, gạo, ngô, khoai, quả chín. Bằng phương pháp lên men người ta thu được etanol
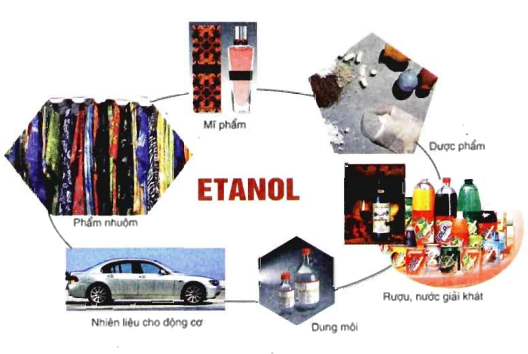
VI. ỨNG DỤNG

.jpg)
.jpg)




.jpg)
.jpg)










