I - TRẠNG THÁI TỰ NHIÊN. ĐIỀU CHẾ
1. Trạng thái tự nhiên
Giống như clo, brom tồn tại trong tự nhiên ở dạng hợp chất, chủ yếu là muối bromua của kali, natri, magie. Hàm lượng brom trong tự nhiên ít hơn clo và flo. Bromua kim loại có trong nước biển, nước của một số hồ cùng với muối clorua.
2. Điều chế
Nguồn chính để điều chế brom là nước biển. Sau khi đã lấy muối ăn khỏi nước biển, phần còn lại có chứa nhiều bromua của natri và kali. Để thu được brom, người ta cho khí clo sục qua dung dịch bromua:
2NaBr+Cl2→2NaCl+Br2
Như vậy, việc điều chế brom dựa trên sự oxi hóa ion Br−, chất oxi hóa là clo.
II - TÍNH CHẤT. ỨNG DỤNG
1. Tính chất
Brom là chất lỏng màu đỏ nâu, dễ bay hơi. Brom và hơi brom rất độc. Brom rơi vào da sẽ gây bỏng nặng. Brom cũng là chất oxi hóa mạnh nhưng kém clo. Brom oxi hoá nhiều kim loại, các phản ứng đều tỏa nhiệt. Với hiđro, brom có phản ứng khi đun nóng (không gây nổ), phản ứng cũng tỏa nhiệt nhưng ít hơn so với phản ứng của clo:
H2(k)+Br2(1)→2HBr(k);ΔH=−71,98kJ
Brom oxi hóa được ion I−:
Br2+2NaI→2NaBr+I2
Brom tác dụng với nước tương tự clo nhưng khó khăn hơn:
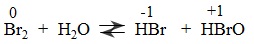
Brom tác dụng với nước tương tự clo nhưng khó khăn hơn:
Br2+5Cl2+6H2O→2HBrO3+10HCl
2. Ứng dụng
Brom được dùng chế tạo một số dược phẩm, phẩm nhuộm,...Nó cũng được dùng chế tọa bạc bromua (AgBr) là chất nhạy cảm với ánh sáng để tráng lên phim ảnh.
III - MỘT SỐ HỢP CHẤT CỦA BROM
1. Hiđro bromua và axit bromhiđric
Để điều chế hiđro bromua, người ta thủy phân photpho tribromua.
PBr3+3H2O→H3PO3+3HBr
Trong thực tế, người ta cho brom tác dụng trực tiếp với photpho và nước.
Ở nhiệt độ thường, HBr là chất khí, không màu, "bốc khói" trong không khí ẩm và rất dễ tan trong nước. Dung dịch HBr trong nước được gọi là dung dịch axitbromhiđric.Axitbromhiđric là một axit mạnh, mạnh hơn axit clohiđric.
Tính khử HBr (ở trạng thái khí cũng như trong dung dịch) mạnh hơn HCl.HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4 → Br2+ SO2+2H2O
Dung dịch HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dung dịch HF và HCl không có phản ứng này):
4HBr+O2→2H2O+2Br2
Trong các muối của axit bromhiđric, AgBr được sử dụng nhiều. Chất này bị phân hủy khi gặp ánh sáng:
2AgBr→2Ag+Br2
Vì vậy, AgBr được dùng chế tạo phim ảnh.
2. Hợp chất chứa oxi của brom
Axithipobromơ(HBrO) có thể được điều chế tương tự như axit hipoclorơ:
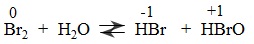
Tính bền, tính oxi hóa và tính axit của HBrO đều kém hơn HClO.
Axitbromic(HBrO3) được điều chế bằng cách dùng nước clo oxi hóa brom. Brom cũng tạo ra được axitpebromic(HBrO4) .
Như vậy, cũng giống như clo, trong các hợp chất có oxi, brom thể hiện số oxi hóa dương (+1,+3,+5,+7).

.jpg)
.jpg)




.jpg)
.jpg)










