1. Khái niệm
Bazơ (bắt nguồn từ từ tiếng Pháp base /baz/), có công thức hoá học chung là B(OH)x. Một định nghĩa phổ biến của bazơ theo Svante Arrhenius là một hợp chất hóa học hoặc là cung cấp các ion hiđrôxít hoặc là hấp thụ các ion hiđrô khi hòa tan trong nước. Các bazơ và các axít được nói đến như là các chất ngược nhau vì hiệu ứng của axit là tăng nồng độ ion hydroni (H3O+) trong nước, còn bazơ thì làm giảm nồng độ của ion này. Các bazơ theo Arrhenius là những chất hòa tan trong nước và có pH lớn hơn 7 khi ở trong dung dịch.Bazơ là hợp chất mà phân tử có một nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH).
Bazơ, có công thức hoá học chung là Bₓ. Một định nghĩa phổ biến của bazơ theo Svante Arrhenius là một hợp chất hóa học hoặc là cung cấp các ion hiđrôxít hoặc là hấp thụ các ion hiđrô khi hòa tan trong nước.
2. Một số bazơ thông dụng
Natri hiđroxit
Amoniac (NH3) và các amin.
Pyridin và các bazơ vòng thơm khác.
Các hiđrôxít kim loại như hiđrôxít natri (NaOH) hay hiđrôxít kali (KOH).
Nhiều ôxít kim loại tạo ra hiđrôxít bazơ với nước (anhiđrít).
3. Tính chất vật lý chung của bazơ
Những tính chất chung của các loại bazơ bao gồm:
- Có cảm giác nhờn, hoặc có mùi và có cảm giác như xà phòng khi cầm trên tay, vì sự xà phòng hoá của Lipid trong da người.
- Bazơ nồng độ cao và bazơ mạnh có tính ăn mòn chất hữu cơ và tác dụng mạnh với các hợp chất axit.
- Đổi màu các chất chỉ thị: dung dịch bazơ đổi màu quỳ tím thành màu xanh, dung dịch Phenolphthalein không màu thành màu hồng, giữ nguyên màu xanh của bromothymol, và đổi màu methyl cam thành màu vàng.
- Độ pH của dung dịch bazơ luôn lớn hơn 7.
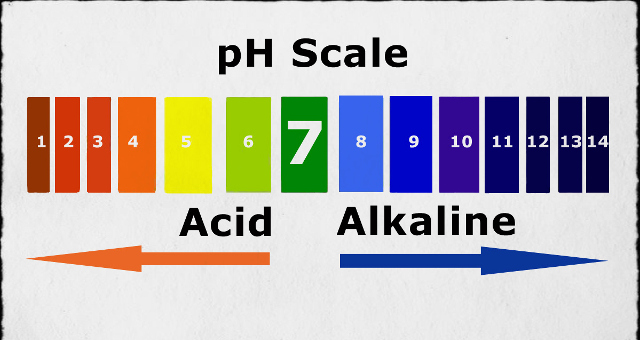
- Bazơ có vị đắng.
- Có các Bazơ tan được trong nước: Na, Cs, K, Rb, Li, Fr: kiềm hóa trị 1 hoặc Ca, Sr, Ba, Ra: kiềm thổ hóa trị 2 (trừ Mg,Be), Amoniac (NH3) và các Ankyl amin như CH3NH2,... hay các amin của hợp chất (CnH2n-1)-,(CnH2n-3)- như: C2H3NH2, C3H3NH2,... Tạo thành các dung dịch Bazơ là NaOH, Ca(OH)2, KOH, Ba(OH)2, LiOH,...
- Bazơ không tan: Fe(OH)2, Fe(OH)3, Cu(OH)2, Zn(OH)2, Al(OH)3..., Mg(OH)2, Be(OH)2 và các Amin vòng thơm như C6H5NH2,...
- Amoniac, các Ankyl amin và amin của các hợp chất (CnH2n-1)-,(CnH2n-3)- dễ bay hơi
- Bazơ tan có thể làm cho quỳ tím chuyển màu xanh - phenol phtalein chuyển màu đỏ.
4. Tính chất hóa học
a. Tác dụng của dung dịch bazơ với chất chỉ thị màu
- Quỳ tím chuyển sang màu xanh.
- Phenolphtalin không màu chuyển sang màu hồng.
b. Tác dụng của bazơ với axit
Bazo(Tan và không tan) + Axit → Muối + Nước
Ví dụ:
KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
c. Tác dụng của bazơ với oxit axit
Bazơ + Oxit axit → Muối + Nước
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O
d. Tác dụng của bazơ với muối
Kiềm (bazơ tan) + Muối tan → Muối mới + Bazơ mới
Điều kiện: muối hoặc bazơ mới tạo thành phải không tan.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
e. Nhiệt phân bazơ không tan ở nhiệt độ cao
Bazơ không tan → Oxit bazơ + Nước
VD: Cu(OH)2 → CuO + H2O
5. Ứng dụng
- Trong ngành công nghiệp hóa chất, dược: Được sử dụng để sản xuất hay bán các sản phẩm có chứa gốc Sodium như Sodium phenolate (sản xuất thuốc Aspirin), Sodium hypochlorite (Javen ) làm chất tẩy trắng, chất khử trùng, ….
- Được sử dụng làm hóa chất để xử lý đối với gỗ, tre, nứa,…để làm nguyên liệu sản xuất giấy dựa theo phương pháp Sulphate và Soda.
- Trong ngành công nghiệp dệt, nhuộm: Nhiều bazơ được sử dụng để làm chất phân hủy pectins, sáp trong khâu xử lý vải thô, khiến cho vải thêm bóng và nhanh hấp thụ màu cho vải nhuộm.
- Sử dụng bazơ để pha chế dung dịch tẩy rửa chai lọ, các thiết bị trong các nhà máy bia. Hoặc là dùng để pha chế dung dịch Kiềm nhằm xử lý rau, hoa quả trước khi chế biến hoặc đóng hộp chúng,…

.jpg)
.jpg)




.jpg)
.jpg)










